Acetileno, preparación, propiedades, reacciones químicas

Acetileno, preparación, propiedades, y reacciones químicas.
Acetileno, C2H2 - clase de materia orgánica, alquinos, hidrocarburos insaturados.
Acetileno, fórmula, gas, especificaciones, caracteristicas
Propiedades físicas del acetileno
Propiedades químicas del acetileno
Producción de acetileno en industria y laboratorios
Reacción química - ecuación acetileno
La aplicación y uso de acetileno.
Explosividad del acetileno y seguridad en la manipulación.
Acetileno, fórmula, gas, caracteristicas:
Acetileno (también - jene) - clase de materia orgánica, alquinos, insaturado hidrocarburoque consta de dos átomos de carbono y dos átomos de hidrógeno.
La química fórmula de acetileno es C2H2. Fórmula estructural de acetileno, CH≡CH. Isómeros no tiene.
La estructura de la molécula de acetileno.:
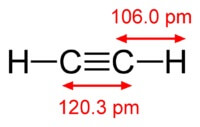
Acetileno tiene un triple enlace entre átomos de carbono.
Acetileno - un gas incoloro, sin sabor ni olor. Sin embargo, el acetileno técnico contiene impurezas - fósforo hidrógeno, sulfuro de hidrógeno, etc., que le dan un olor acre.
Más fácil aire. Densidad comparada con la densidad del aire de 0.9.
Muy inflamable gas. Inflamable y explosivo.
Acetileno es uno de los pocos compuestos, combustión y explosión que es posible en ausencia de oxigeno u otros agentes oxidantes.
Mezclas de acetileno con aire es explosivo en una amplia gama de concentraciones. Los peligros de explosión se reducen cuando se diluye acetileno otros gases, por ejemplo nitrógeno, metano o propano.
Acetileno requiere mucho cuidado en el manejo. Puede explotar por el impacto, cuando se calienta a 500 ° C o cuando se comprime por encima 0.2 MPa a temperatura ambiente. Un chorro de acetileno liberado al aire libre aire, puede encenderse con la chispa más pequeña, incluida la descarga de electricidad estática del dedo. Almacenamiento de acetileno utilizando especial cilindrosrelleno de material poroso empapado en acetona. El acetileno se almacena en solución con acetona..
Ligeramente soluble en agua. Muy soluble en acetona. Soluble en otras sustancias orgánicas (gasolina, benceno, etc.)
Acetileno tiene un ligero efecto tóxico.
Propiedades físicas del acetileno:
| Nombre del parámetro: | Valor: |
| Color | sin color |
| El olor | inodoro |
| Gusto | no taste |
| Estado agregado (a 20 ° C y presión atmosférica de 1 CAJERO AUTOMÁTICO.) | gas |
| Densidad (a 20 ° C y presión atmosférica de 1 CAJERO AUTOMÁTICO.) kg / m3 | 1,0896 |
| Densidad (a 0 ° C y presión atmosférica de 1 CAJERO AUTOMÁTICO.) kg / m3 | 1,173 |
| Punto de fusion, ° C | -80,8 |
| Punto de ebullición, ° C | -80,55 |
| Triple punto, ° C | 335 |
| La temperatura de autoignición, ° C | 335 |
| La presión de autoencendido, MPa | 0,14-0,16 |
| Temperatura crítica*, ° C | De 35.94 |
| Presión crítica, MPa | 6,26 |
| Concentración explosiva de la mezcla de gas con aire., % por volumen | 2.1 a 100 |
| Calor específico de combustión, MJ / kg | 56,9 |
| Temperatura de la llama, ° C | 3150-3200 |
| Masa molar, g / mol | 26,038 |
* a temperaturas superiores a la temperatura crítica el gas no se puede condensar a ninguna presión.
Propiedades químicas del acetileno:
Las propiedades químicas del acetileno son similares a las propiedades de otros representantes de varios alquinos.. Por lo que se caracteriza por las siguientes reacciones químicas:
1. acetileno galogenirovannami:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometano);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabromoetano).
La reacción procede por etapas con la formación de derivados. de alcanos.
Durante esta reacción, acetileno decolorar bromo agua.
2. acetileno hidrohalogenación:
CH≡CH + HBr → CH2 = CHBr (bromato).
3. hidratación de acetileno (reacción Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldehído ) (kat = HgSO4, Hg(NUMERO 3)2).
4. trimerización de acetileno (reacción Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benceno) (kat = carbón activado, a = 450-500 LOS).
La reacción de trimerización del acetileno es un caso especial de la reacción. de polimerización de acetileno ocurre al pasar acetileno sobre activado carbón a una temperatura de 450-500 LOS.
5. dimerización de acetileno:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (obtenido vinil acetileno) (kat = solución acuosa de CuCl y NH 4 CL).
La reacción de dimerización del acetileno es un caso especial de la reacción. de polimerización de acetileno.
6. la combustión de acetileno:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
El acetileno arde con una llama blanca brillante..
7. la oxidación del acetileno.
La reacción y sus productos están determinados por el entorno en el que se produce..
8. recuperación de acetileno:
CH≡CH + H2 → C2H4 (etileno) (kat = Ni, Pd o Pt, aumentado a);
CH≡CH + 2H2 → C2H6 (etano) (kat = Ni, Pd o Pt, aumentado a).
Producción de acetileno en la industria y el laboratorio.. Reacción química - ecuación acetileno:
Acetileno en el laboratorio es el resultado de las siguientes reacciones químicas:
1. la acción del agua sobre el carburo de calcio:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. deshidrogenación de metano:
2CH4 → C2H2 + 3H2 (sujeto a > 1500 jefe).
3. deshidrogenación de etileno:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, a = 400-600 ° C).
Acetileno en la industria recibir de las siguientes formas y métodos:
4. método de carburo:
Primero obtenga cal del carbonato de calcio.
CaCO3 → Alto + CO2. (a = 900-1200 jefe).
Entonces consigue un carburo de calcio, fusionando óxido de calcio y coque en un horno eléctrico a una temperatura de 2500-3000 ° C.
Alto + 3C → CaC2 + CO. (a = 2500-3000 LOS).
Más lejos, se trata el carburo de calcio con agua en una reacción conocida.
CaC2 + H2O → CA(Oh)2 + C2H2.
El resultado es un acetileno de alta pureza 99.9 %.
5. agrietamiento a alta temperatura del metano:
El craqueo a alta temperatura del metano se lleva a cabo según la reacción conocida degidrirovaniya del metano en un horno de arco eléctrico a una temperatura de 2000-3000 ° C y un voltaje entre los electrodos de 1000 V. la Salida de acetileno es 50 %.
6. los diversos modos de pirólisis del metano:
Un tipo de craqueo a alta temperatura del metano es la pirólisis regenerativa. (Proceso Wulff), pirólisis oxidativa (Proceso Sachs o proceso BASF), pirólisis homogénea, pirólisis en el medio de baja temperatura plasma.
Así, durante la pirólisis regenerativa, primero queme el metano y caliente la boquilla del horno a 1350-1400 ° C. Luego, a través de una boquilla calentada para cortar el flujo de metano, formando así acetileno.
En el curso de la pirólisis oxidativa, el metano se mezcla con oxígeno y se quema.. El calor resultante sirve para calentar el resto del metano a 1600 ° C, que digidrive en acetileno. El rendimiento de acetileno es 30-32 %.
Durante la pirólisis homogénea de metano y oxígeno se quema en un horno a una temperatura de 2000 ° C. Luego, precalentado a 600 ° C, el resto del metano pasa a través del horno, formando así acetileno.
Durante la pirólisis en un entorno de baja temperatura plasma el metano se calienta mediante un chorro de gas ionizado (argón o hidrógeno).
La aplicación y uso de acetileno.:
- como materia prima en la industria química para la producción de ácido acético, alcohol etílico, solventes, plástica, sintético cauchos, hidrocarbonos aromáticos,
- para soldar con gas y cortar metales,
- para técnica carbón,
- como fuente de muy brillante, luz blanca en el Autonómico lamparas, donde se obtiene por reacción de carburo de calcio y agua.
Explosividad del acetileno y seguridad en la manipulación.:
Acetileno tiene propiedades explosivas.
Por lo tanto, tratamiento con acetileno requiere un estricto cumplimiento de las reglas de seguridad.
Acetileno arde y explota incluso en ausencia de oxígeno y otros agentes oxidantes.
Las mezclas de acetileno con aire son explosivo en una amplia gama de concentraciones.
Un chorro de acetilenolanzado al aire libre, puede encenderse con la chispa más pequeña, incluida la descarga de electricidad estática del dedo.
Acetileno Vzryvaet depende de muchos factores: presión, temperatura, pureza del acetileno, el contenido de humedad, la presencia de catalizadores y otras sustancias y otras razones.
La temperatura de ignición del acetileno. a presión atmosférica normal en el rango 500-600 ° C. Cuando la presión disminuye significativamente la temperatura de ignición del acetileno. Así, a una presión de 2 kgf / cm2 (0.2 MPa, 1,935682 CAJERO AUTOMÁTICO.) la temperatura de ignición del acetileno es igual a 630 ° C. Y a una presión de 22 kgf / cm2 (2.2 MPa, 21,292502 CAJERO AUTOMÁTICO.) la temperatura de ignición del acetileno igual a 350 ° C.
La presencia de acetileno de partículas de diferentes sustancias aumenta el contacto superficial y por lo tanto reduce la temperatura de ignición a presión atmosférica.. Por ejemplo, El carbón activado reduce la temperatura de ignición del acetileno a 400 ° C, el hidrato de óxido de hierro (oxido) - hasta 280-300 ° C, virutas de hierro - hasta 520 ° C, virutas de latón hasta 500-520 ° C, carburo de calcio, hasta 500 ° C, óxido de aluminio - hasta 490 ° C, virutas de cobre - 460 ° C, el óxido de hierro - 280 ° C, óxido de cobre hasta 250 ° C.
Explosividad del acetileno disminuye con la dilución de acetileno con otros gases, por ejemplo nitrógeno, metano o propano.
En determinadas condiciones, el acetileno reacciona con cobre, plata y mercurio para formar compuestos explosivos. Por lo tanto, en la fabricación de equipos de acetileno (p.ej., valvulas, cilindros) no utilice aleacionesque contiene más de 70 % Con.
Almacenamiento y transporte de acetileno., utilizando cilindros de acero especial color blanco (con una inscripción roja “A”) lleno de un poroso inerte material (p.ej., carbón). Así el acetileno se almacena y transporta en estas bolsas en forma de una solución de acetileno en acetona bajo presión de 1.5-2.5 MPa.
Nota: © Foto //www.pexels.com, //pixabay.com



