乙炔, 制备, 属性, 化学反应

乙炔, 制备, 属性, 和化学反应.
乙炔, C2H2 –有机物类别, 炔烃, 不饱和烃.
乙炔, 式, 加油站, 特征:
乙炔 (还–珍妮) –有机物类, 炔烃, 不饱和 烃由两个碳原子和两个氢原子组成.
化学 乙炔的分子式为 C2H2. 乙炔的结构式, ≡. 异构体还没有.
乙炔分子的结构:
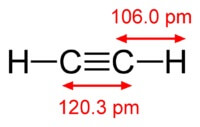
乙炔 原子之间具有三键 碳.
乙炔 –无色气体, 没有味道和气味. 然而, 工业乙炔中含有杂质–磷 氢, 硫化氢, 等等, 散发出刺鼻的气味.
更轻松 空气. 密度与密度比较 空气 的 0.9.
非常易燃 加油站. 易燃易爆.
乙炔 在少数化合物中, 在不存在的情况下可能发生燃烧和爆炸 氧气 或其他氧化剂.
乙炔与 空气 在很宽的浓度范围内具有爆炸性. 乙炔稀释后的其他气体可减少爆炸危险, 例如 氮, 甲烷 要么 丙烷.
乙炔 需要非常小心的处理. 可能因震动而爆炸, 当加热到 500 °C或以上压缩 0.2 室温下MPa. 一股乙炔释放到室外 空气, 可以从最小的火花点燃, 包括手指上的静电释放. 使用特殊的乙炔储存 气瓶充满用丙酮浸透的多孔材料. 他们将乙炔与丙酮一起储存在溶液中.
微溶于 水. 易溶于丙酮. 溶于其他有机物质 (汽油, 苯, 等等)
乙炔 有轻微的毒性作用.
乙炔的物理性质:
| 参数名称: | 值: |
| 颜色 | 无色 |
| 气味 | 无味的 |
| 味道 | 没有味道 |
| 汇总状态 (在 20 °C和大气压 1 自动取款机。) | 加油站 |
| 密度 (在 20 °C和大气压 1 自动取款机。) 千克/立方米 | 1,0896 |
| 密度 (在 0 °C和大气压 1 自动取款机。) 千克/立方米 | 1,173 |
| 熔点, °C | -80,8 |
| 沸点, °C | -80,55 |
| 三点, °C | 335 |
| 自燃温度, °C | 335 |
| 自燃压力, 兆帕 | 0,14-0,16 |
| 临界温度*, °C | 的 35.94 |
| 临界压力, 兆帕 | 6,26 |
| 爆炸性浓度的气体与空气的混合物, % 按体积 | 2.1 至 100 |
| 燃烧比热, MJ /公斤 | 56,9 |
| 火焰温度, °C | 3150-3200 |
| 摩尔质量, 克/摩尔 | 26,038 |
* 在高于临界温度的温度下 气体 不能在任何压力下凝结.
乙炔的化学性质:
乙炔的化学性质类似于许多炔烃的其他代表的性质. 所以它的特点是以下化学反应:
1. galiroirovannami乙炔:
≡ + Br2→CHBr = CHBr (1,2-二溴甲烷);
CHBr = CHBr + 溴→CHBr2-CHBr2 (1,1,2,2-四溴乙烷).
反应逐步进行,形成衍生物 烷烃.
在这个反应期间, 乙炔变色溴 水.
2. 氢卤化乙炔:
≡ + HBr→CH2 = CHBr (溴酸盐).
3. 乙炔的水合 (反应迈克尔·G. 库切罗夫, 1881):
≡ + 水 → [CH2 = CH-OH] (烯醇) →CH3-CH = O (乙醛 ) (钾= HgSO4, 汞(3号)2).
4. 乙炔的三聚 (反应Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH→C6H6 (苯) (钾=活性炭, 到= 450-500 的).
乙炔三聚反应是反应的特例 乙炔聚合反应 通过使乙炔通过活化而发生 木炭 在...的温度下 450-500 的.
5. 乙炔二聚:
≡ + CH≡CH→CH2 =CH-C≡CH (得到乙烯基乙炔) (钾= CuCl和NH的水溶液 4 CL).
乙炔的二聚反应是该反应的特例 乙炔聚合反应.
6. 乙炔燃烧:
2SN≡CH + 5О2→4СО2 + 2Н2О.
乙炔燃烧,有白色明亮的火焰.
7. 乙炔的氧化.
反应及其产物取决于发生反应的环境.
8. 乙炔的回收:
≡ + H2→C2H4 (乙烯) (钾=镍, 钯或铂, 增加到);
≡ + 2H2→C2H6 (乙烷) (钾=镍, 钯或铂, 增加到).
在工业和实验室中生产乙炔. 化学反应–乙炔方程:
乙炔 在实验室里 是以下化学反应的结果:
1. 水对电石的作用:
CaC2 + 水→加利福尼亚(哦)2 + C2H2.
2. 甲烷脱氢:
2CH4→C2H2 + 3H2 (服从 > 1500 超频).
3. 乙烯脱氢:
CH2 = CH2→CH≡CH+ H2 (钾=铂, 你, 氧化铝, Cr2O3, 到= 400-600 °C).
乙炔 在行业中 通过以下方式和方法接收:
4. 硬质合金法:
首先从碳酸钙中获得石灰.
碳酸钙→高 + 二氧化碳. (到= 900-1200 温度).
然后得到碳化物 钙, 融合 氧化钙 然后在电炉中于 2500-3000 °C.
高的 + 3C→CaC2 + 一氧化碳. (到= 2500-3000 的).
进一步, 电石处理 与水 以已知的反应.
CaC2 + 水→加利福尼亚(哦)2 + C2H2.
结果是高纯度的乙炔是 99.9 %.
5. 甲烷高温裂解:
甲烷的高温裂解是根据已知的甲烷反应反应在电弧炉中进行的。 2000-3000 °C和电极之间的电压 1000 V. 乙炔的产量为 50 %.
6. 甲烷热解的各种模式:
甲烷的一种高温裂解是再生热解 (沃尔夫工艺), 氧化热解 (萨克斯工艺或巴斯夫工艺), 均相热解, 低温介质中的热解 等离子体.
从而, 在再生热解过程中,首先燃烧甲烷并加热喷嘴 炉子的 至 1350-1400 °C. 然后通过加热的喷嘴切断甲烷流量, 从而形成乙炔.
甲烷在氧化热解过程中与氧气混合并燃烧. 产生的热量用于将剩余的甲烷加热到 1600 °C, 乙炔中的数字驱动. 乙炔的收率为 30-32 %.
在甲烷的均相热解过程中,氧气被燃烧 一个熔炉 在...的温度下 2000 °C. 然后, 预热到 600 °C, 剩余的甲烷通过炉子, 从而形成乙炔.
在低温环境下的热解过程中 等离子体 甲烷通过离子化气体的射流加热 (氩气 要么 氢).
乙炔的应用与用途:
–作为化学工业中生产乙酸的原料, 乙醇, 溶剂, 塑料制品, 合成的 橡胶, 芳香烃,
–用于气焊和切割金属,
–技术 碳,
–作为非常明亮的来源, 自主白光 台灯, 通过电石与水反应获得的.
乙炔的爆炸性及处理的安全性:
乙炔 具有爆炸性.
因此, 乙炔处理 需要严格遵守安全规则.
乙炔 即使没有氧气和其他氧化剂也会燃烧和爆炸.
乙炔与空气的混合物是 浓度范围很广的炸药.
乙炔喷射释放到露天, 可以从最小的火花点燃, 包括手指上的静电释放.
Vzryvaet乙炔 取决于许多因素: 压力, 温度, 乙炔的纯度, 水分含量, 催化剂和其他物质的存在及其他原因.
乙炔的着火温度 在常压–大气压范围内 500-600 °C. 当压力明显降低时乙炔的着火温度. 从而, 在...的压力下 2 千克力/平方厘米 (0.2 兆帕, 1,935682 自动取款机。) 乙炔的着火温度等于 630 °C. 并且在 22 千克力/平方厘米 (2.2 兆帕, 21,292502 自动取款机。) 乙炔的着火温度等于 350 °C.
不同物质颗粒中乙炔的存在会增加表面接触,从而降低大气压下的着火温度. 例如, 活性炭将乙炔的着火温度降低到 400 °C, 氧化铁的水合物 (锈) - 取决于 280-300 °C, 铁屑–高达 520 °C, 黄铜屑 500-520 °C, 钙的碳化物, 取决于 500 °C, 氧化铝–最高 490 °C, 铜屑– 460 °C, 氧化铁– 280 °C, 氧化铜高达 250 °C.
乙炔的爆炸性 随着乙炔与其他物质的稀释而减少 气体, 例如氮气, 甲烷或丙烷.
在某些条件下,乙炔会与 铜, 银 和 汞 形成爆炸性化合物. 因此, 在乙炔设备的制造中 (例如, 阀门, 气瓶) 不使用 合金包含超过 70 % 用.
乙炔的储存和运输, 使用特殊的钢瓶,白色 (带有红色题字 “一种”) 充满惰性多孔 材料 (例如, 木炭). 从而 乙炔储存和运输 在乙压下乙炔在丙酮中的溶液形式 1.5-2.5 兆帕.
注意: ©照片//www.pexels.com, //Foto.com



