Asetilen, hazırlık, özellikleri, kimyasal reaksiyonlar

Asetilen, hazırlık, özellikleri, ve kimyasal reaksiyonlar.
Asetilen, C2H2 - organik madde sınıfı, alkinler, doymamış hidrokarbonlar.
Asetilen, formül, gaz, özellikler, özellikleri
Asetilenin fiziksel özellikleri
Asetilenin kimyasal özellikleri
Endüstride ve laboratuarlarda asetilen üretimi
Kimyasal reaksiyon - denklem asetilen
Asetilen uygulaması ve kullanımı
Asetilenin patlayıcılığı ve kullanımda güvenlik
Asetilen, formül, gaz, özellikleri:
Asetilen (ayrıca - jene) - organik madde sınıfı, alkinler, doymamış hidrokarboniki karbon atomu ve iki hidrojen atomundan oluşur.
Kimyasal asetilenin formülü C2H2. Asetilenin yapısal formülü, CH≡CH. İzomerler.
Asetilen molekülünün yapısı:
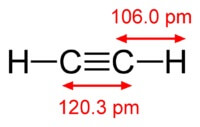
Asetilen atomlar arasında üçlü bir bağ vardır karbon.
Asetilen - renksiz bir gaz, tatsız ve kokusuz. Yine de, teknik asetilen safsızlıklar içerir - fosfor hidrojen, hidrojen sülfit, vb., ona keskin bir koku veren.
Daha kolay hava. Yoğunluğa kıyasla yoğunluk havanın nın-nin 0.9.
Çok yanıcı gaz. Yanıcı ve patlayıcı.
Asetilen birkaç bileşik arasında, yokluğunda mümkün olan yanma ve patlama oksijen veya diğer oksitleyici maddeler.
Asetilen karışımları ile hava çok geniş bir konsantrasyon aralığında patlayıcıdır. Asetilen diğer gazlar seyreltildiğinde patlama tehlikeleri azalır, Örneğin azot, metan veya propan.
Asetilen kullanımda büyük özen gerektirir. Şoktan patlayabilir, ısıtıldığında 500 ° C veya yukarıda sıkıştırıldığında 0.2 Oda sıcaklığında MPa. Dış ortama salınan asetilen akışı hava, en küçük kıvılcımdan tutuşabilir, parmaktan statik elektrik boşalması dahil. Asetilenin özel olarak depolanması silindirlerasetonla ıslatılmış gözenekli malzeme ile doldurulmuş. Asetilen, aseton ile çözelti içinde depolanır..
Biraz çözünür Su. Asetonda çok çözünür. Diğer organik maddelerde çözünür (benzin, benzen, vb.)
Asetilen hafif toksik etkiye sahiptir.
Asetilenin fiziksel özellikleri:
| Parametre adı: | Değer: |
| Renk | renksiz |
| Koku | kokusuz |
| Damak zevki | tatsız |
| Toplu durum (-de 20 ° C ve atmosferik basınç 1 ATM.) | gaz |
| Yoğunluk (-de 20 ° C ve atmosferik basınç 1 ATM.) kg / m3 | 1,0896 |
| Yoğunluk (-de 0 ° C ve atmosferik basınç 1 ATM.) kg / m3 | 1,173 |
| Erime noktası, ° C | -80,8 |
| Kaynama noktası, ° C | -80,55 |
| Üçlü nokta, ° C | 335 |
| Kendiliğinden tutuşma sıcaklığı, ° C | 335 |
| Kendiliğinden tutuşma basıncı, MPa | 0,14-0,16 |
| Kritik sıcaklık*, ° C | Nın-nin 35.94 |
| Kritik baskı, MPa | 6,26 |
| Gaz karışımının hava ile patlayıcı konsantrasyonu, % hacimce | 2.1 -e 100 |
| Özgül yanma ısısı, MJ / kg | 56,9 |
| Alev sıcaklığı, ° C | 3150-3200 |
| Molar kütle, g / mol | 26,038 |
* kritik sıcaklığın üzerindeki sıcaklıklarda gaz herhangi bir basınçta yoğunlaştırılamaz.
Asetilenin kimyasal özellikleri:
Asetilenin kimyasal özellikleri, bir dizi alkinin diğer temsilcilerinin özelliklerine benzer.. Bu nedenle aşağıdaki kimyasal reaksiyonlarla karakterizedir:
1. galogenirovannami asetilen:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometan);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabromoetan).
Reaksiyon, türevlerin oluşumu ile aşamalar halinde ilerler alkanların.
Bu reaksiyon sırasında, asetilen renksiz brom Su.
2. hidrohalojenasyon asetilen:
CH≡CH + HBr → CH2 = CHBr (bromat).
3. asetilenin hidrasyonu (tepki Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (Enol) → CH3-CH = O (asetaldehit ) (kat = HgSO4, Hg(Na2O)2).
4. asetilenin trimerizasyonu (reaksiyon Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzen) (kat = aktif karbon, to = 450-500 THE).
Asetilenin trimerizasyonunun reaksiyonu, reaksiyonun özel bir durumudur. asetilenin polimerizasyonunun asetilenin aktif hale getirilmesiyle oluşur odun kömürü sıcaklıkta 450-500 THE.
5. asetilenin dimerizasyonu:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (elde edilen vinil asetilen) (kat = sulu CuCl ve NH çözeltisi 4 CL).
Asetilenin dimerizasyonunun reaksiyonu, reaksiyonun özel bir durumudur asetilenin polimerizasyonunun.
6. asetilenin yanması:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Asetilen beyaz parlak bir alevle yanar.
7. asetilenin oksidasyonu.
Reaksiyon ve ürünleri, oluştuğu ortam tarafından belirlenir..
8. asetilenin geri kazanımı:
CH≡CH + H2 → C2H4 (etilen) (kat = Ni, Pd veya Pt, Artırıldı);
CH≡CH + 2H2 → C2H6 (etan) (kat = Ni, Pd veya Pt, Artırıldı).
Endüstride ve laboratuvarda asetilen üretimi. Kimyasal reaksiyon - denklem asetilen:
Asetilen laboratuvarda aşağıdaki kimyasal reaksiyonların sonucudur:
1. suyun kalsiyum karbür üzerindeki etkisi:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. metanın dehidrojenasyonu:
2CH4 → C2H2 + 3H2 (tabi > 1500 OC).
3. etilen dehidrojenasyonu:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 400-600 ° C).
Asetilen endüstride aşağıdaki yol ve yöntemlerle almak:
4. karbür yöntemi:
Önce kalsiyum karbonattan kireç alın.
CaCO3 → Yüksek + CO2. (to = 900-1200 oC).
O zaman bir karbür alın kalsiyum, kaynaştırma kalsiyum oksit ve bir elektrikli fırında kok kömürü 2500-3000 ° C.
Yüksek + 3C → CaC2 + CO. (to = 2500-3000 THE).
Daha ileri, kalsiyum karbür tedavi edilir su ile bilinen bir reaksiyonda.
CaC2 + H2O → CA(Oh)2 + C2H2.
Sonuç, yüksek saflıkta bir asetilen 99.9 %.
5. yüksek sıcaklıkta metanın kırılması:
Metanın yüksek sıcaklıkta parçalanması, bir elektrik ark fırınında metanın bilinen reaksiyon degidrirovaniya reaksiyonuna göre, 2000-3000 ° C ve elektrotları arasındaki voltaj 1000 V. Asetilen çıkışı 50 %.
6. metanın çeşitli piroliz modları:
Bir tür yüksek sıcaklıkta metan kırılması rejeneratif pirolizdir (Wulff süreci), oksidatif piroliz (Sachs süreci veya BASF süreci), homojen piroliz, düşük sıcaklık ortamında piroliz plazma.
Böylece, rejeneratif piroliz sırasında önce metan yakıp nozulu ısıtın fırının -e 1350-1400 ° C. Daha sonra metan akışını kesmek için ısıtılmış bir nozul aracılığıyla, böylece asetilen oluşturur.
Metanın oksidatif pirolizi sırasında oksijenle karıştırılır ve yakılır.. Ortaya çıkan ısı, metanın kalanını ısıtmaya yarar. 1600 ° C, asetilende hangi digidrive. Asetilen verimi 30-32 %.
Metan ve oksijenin homojen pirolizi sırasında yanar bir fırın sıcaklıkta 2000 ° C. Sonra, önceden ısıtılmış 600 ° C, metanın geri kalanı fırından geçirilir, böylece asetilen oluşturur.
Düşük sıcaklık ortamında piroliz sırasında plazma metan, iyonize gaz jeti ile ısıtılır (argon veya hidrojen).
Asetilen uygulaması ve kullanımı:
- kimya endüstrisinde asetik asit üretimi için hammadde olarak, etil alkol, çözücüler, plastik, sentetik kauçuklar, aromatik hidrokarbonlar,
- gaz kaynağı ve metal kesme için,
- teknik için karbon,
- çok parlak bir kaynak olarak, Otonom'da beyaz ışık lambalar, kalsiyum karbür ve suyun reaksiyonuyla elde edildiği yer.
Asetilenin patlayıcılığı ve kullanımda güvenlik:
Asetilen patlayıcı özelliklere sahiptir.
Bu nedenle, asetilen ile muamele güvenlik kurallarına sıkı sıkıya bağlılık gerektirir.
Asetilen oksijen ve diğer oksitleyici ajanların yokluğunda bile yanar ve patlar.
Asetilenin hava ile karışımları çok geniş bir konsantrasyon aralığında patlayıcı.
Bir asetilen jetiaçık havaya bırakıldı, en küçük kıvılcımdan tutuşabilir, parmaktan statik elektrik boşalması dahil.
Vzryvaet asetilen birçok faktöre bağlıdır: basınç, sıcaklık, asetilenin saflığı, nem içeriği, katalizörlerin ve diğer maddelerin varlığı ve diğer nedenler.
Asetilenin tutuşma sıcaklığı normal - aralıktaki atmosferik basınçta 500-600 ° C. Basınç, asetilenin tutuşma sıcaklığını önemli ölçüde düşürdüğünde. Böylece, bir baskıda 2 kgf / cm2 (0.2 MPa, 1,935682 ATM.) asetilenin tutuşma sıcaklığı eşittir 630 ° C. Ve bir baskı altında 22 kgf / cm2 (2.2 MPa, 21,292502 ATM.) asetilenin tutuşma sıcaklığı eşittir 350 ° C.
Farklı maddelerin partiküllerinin asetilen varlığı yüzey temasını artırır ve böylece atmosferik basınçta tutuşma sıcaklığını düşürür.. Örneğin, aktif karbon asetilenin tutuşma sıcaklığını düşürür 400 ° C, demir oksit hidratı (pas) - kadar 280-300 ° C, demir talaşı - kadar 520 ° C, kadar pirinç talaşı 500-520 ° C, kalsiyum karbür, kadar 500 ° C, alüminyum oksit - en fazla 490 ° C, bakır talaşı - 460 ° C, demir oksit - 280 ° C, bakır oksit kadar 250 ° C.
Asetilenin patlayıcılığı asetilenin diğeriyle seyreltilmesi ile azalır gazlar, örneğin nitrojen, metan veya propan.
Belirli koşullar altında asetilen ile reaksiyona girer bakır, gümüş ve Merkür patlayıcı bileşikler oluşturmak için. Bu nedenle, asetilen ekipmanı imalatında (Örneğin., vanalar, silindirler) kullanmayın alaşımlardaha fazlasını içeren 70 % İle.
Asetilenin depolanması ve taşınması, özel çelik silindirler kullanarak beyaz renk (kırmızı yazı ile “Bir”) inert bir gözenekle dolu malzeme (Örneğin., odun kömürü). Böylece asetilen depolanır ve taşınır bu torbalarda aseton içinde bir asetilen çözeltisi formunda 1.5-2.5 MPa.
Not: © Fotoğraf //www.pexels.com, //Pixabay.com



