Acetylen, förberedelse, egenskaper, kemiska reaktioner

Acetylen, förberedelse, egenskaper, och kemiska reaktioner.
Acetylen, C2H2 - organisk materialklass, alkyner, omättade kolväten.
Acetylen, formel, gas, specifikationer, egenskaper
Fysikaliska egenskaper hos acetylen
Kemiska egenskaper hos acetylen
Produktion av acetylen i industri och laboratorier
Kemisk reaktion - ekvation acetylen
Applicering och användning av acetylen
Explosivitet av acetylen och säkerhet vid hantering
Acetylen, formel, gas, funktioner:
Acetylen (också - jene) - klass för organiskt material, alkyner, omättad kolvätebestående av två kolatomer och två väteatomer.
Kemikalien formel av acetylen är C2H2. Strukturformel av acetylen, CH≡CH. Isomers har inte.
Strukturen för acetylenmolekyl:
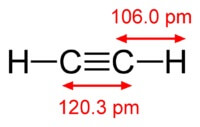
Acetylen har en trippelbindning mellan atomer kol.
Acetylen - en färglös gas, utan smak och lukt. dock, den tekniska acetylen innehåller föroreningar - fosfor väte, vätesulfid, etc., som ger den en skarp lukt.
Lättare luft. Densitet jämfört med densiteten av luften av 0.9.
En mycket brandfarlig gas. Brandfarligt och explosivt.
Acetylen är bland de få föreningarna, förbränning och explosion som är möjlig i frånvaro syre eller andra oxidationsmedel.
Blandningar av acetylen med luft är explosivt i ett mycket brett spektrum av koncentrationer. Explosionsriskerna minskas vid utspädning av andra gaser av acetylen, till exempel kväve, metan eller propan.
Acetylen kräver stor försiktighet vid hantering. Kan explodera av chock, vid uppvärmning till 500 ° C eller vid komprimering ovan 0.2 MPa vid rumstemperatur. En ström av acetylen som släpps ut i utomhus luft, kan antändas från den minsta gnistan, inklusive urladdning av statisk elektricitet från fingret. Lagring av acetylen med special cylindrarfylld med poröst material indränkt med aceton. De acetylen lagras i lösning med aceton.
Något lösligt i vatten. Mycket löslig i aceton. Lösligt i andra organiska ämnen (bensin, bensen, etc.)
Acetylen har en liten giftig effekt.
Fysikaliska egenskaper hos acetylen:
| Parameternamn: | Värde: |
| Färg | utan färg |
| Lukten | luktfri |
| Smak | ingen smak |
| Sammanlagt tillstånd (på 20 ° C och atmosfärstryck av 1 Bankomat.) | gas |
| Densitet (på 20 ° C och atmosfärstryck av 1 Bankomat.) kg / m3 | 1,0896 |
| Densitet (på 0 ° C och atmosfärstryck av 1 Bankomat.) kg / m3 | 1,173 |
| Smältpunkt, °C | -80,8 |
| Kokpunkt, °C | -80,55 |
| Trippel punkt, °C | 335 |
| Självantändningstemperaturen, °C | 335 |
| Självantändningstrycket, MPa | 0,14-0,16 |
| Kritisk temperatur *, °C | Av 35.94 |
| Kritiskt tryck, MPa | 6,26 |
| Explosiv koncentration av gasblandningen med luft, % i volym | 2.1 till 100 |
| Specifik förbränningsvärme, MJ / kg | 56,9 |
| Flam temperatur, °C | 3150-3200 |
| Molmassa, g/mol | 26,038 |
* vid temperaturer över den kritiska temperaturen gasen kan inte kondenseras vid något tryck.
Kemiska egenskaper hos acetylen:
Kemiska egenskaper hos acetylen liknar egenskaper hos andra representanter för ett antal alkyner. Så det kännetecknas av följande kemiska reaktioner:
1. galogenirovannami acetylen:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometan);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabrometan).
Reaktionen fortsätter stegvis med bildandet av derivat av alkaner.
Under denna reaktion, acetylen missfärgad brom vatten.
2. hydrohalogenering acetylen:
CH≡CH + HBr → CH2 = CHBr (bromat).
3. hydratisering av acetylen (reaktion Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldehyd ) (kat = HgSO4, Hg(NR 3)2).
4. trimerisering av acetylen (reaktion Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (bensen) (kat = aktivt kol, till = 450-500 DE).
Reaktionen av trimeriseringen av acetylen är ett speciellt fall av reaktionen av polymerisation av acetylen sker genom att passera acetylen över aktiverad träkol vid en temperatur av 450-500 DE.
5. dimerisering av acetylen:
CH≡CH + CH2CH → CH2 = CH-C2CH (erhållen vinylacetylen) (kat = vattenlösning av CuCl och NH 4 CL).
Reaktionen av dimerisering av acetylen är ett speciellt fall av reaktionen av polymerisation av acetylen.
6. förbränningen av acetylen:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Acetylen brinner med en vit ljus flamma.
7. oxidationen av acetylen.
Reaktionen och dess produkter bestäms av omgivningen där den förekommer.
8. återvinning av acetylen:
CH≡CH + H2 → C2H4 (eten) (kat = Ni, Pd eller Pt, ökat till);
CH≡CH + 2H2 → C2H6 (etan) (kat = Ni, Pd eller Pt, ökat till).
Produktion av acetylen i industrin och laboratoriet. Kemisk reaktion - ekvation acetylen:
Acetylen i laboratoriet är resultatet av följande kemiska reaktioner:
1. verkan av vatten på kalciumkarbid:
CaC2 + H2O → CA(Åh)2 + C2H2.
2. dehydrogenering av metan:
2CH4 → C2H2 + 3H2 (föremål för > 1500 OC).
3. dehydrogenering av eten:
CH2 = CH2 → CH2CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, till = 400-600 °C).
Acetylen inom industrin ta emot på följande sätt och metoder:
4. hårdmetallmetod:
Ta först kalk från kalciumkarbonat.
CaCO3 → Hög + CO2. (till = 900-1200 oC).
Skaffa sedan en hårdmetall kalcium, smälter kalciumoxid och koks i en elektrisk ugn vid en temperatur av 2500-3000 °C.
Hög + 3C → CaC2 + CO. (till = 2500-3000 DE).
Ytterligare, kalciumkarbid behandlas med vatten vid en känd reaktion.
CaC2 + H2O → CA(Åh)2 + C2H2.
Resultatet är en acetylen med hög renhet är 99.9 %.
5. hög temperatur sprickbildning av metan:
Högtemperatursprickning av metan utförs enligt känd reaktion degidrirovaniya av metan i en elektrisk bågugn vid en temperatur av 2000-3000 ° C och en spänning mellan elektroderna på 1000 V. produktionen av acetylen är 50 %.
6. de olika metoderna för pyrolys av metan:
En typ av högtemperatursprickning av metan är regenerativ pyrolys (Wulff-processen), oxidativ pyrolys (Sachs-process eller BASF-process), homogen pyrolys, pyrolys i mediet med låg temperatur plasma.
Således, under den regenerativa pyrolysen först bränn metan och värm upp munstycket av ugnen till 1350-1400 °C. Sedan genom ett uppvärmt munstycke för att stänga av metanflödet, och därigenom bildar acetylen.
Under oxidativ blandning pyrolys av metan med syre och bränns. Den resulterande värmen tjänar till att värma återstoden av metan till 1600 °C, som digidrive i acetylen. Utbytet av acetylen är 30-32 %.
Under den homogena pyrolysen av metan och syre bränns in en ugn vid en temperatur av 2000 °C. Sedan, förvärmd till 600 °C, resten av metanet passerar genom ugnen, och därigenom bildar acetylen.
Under pyrolys i en miljö med låg temperatur plasma metan värms upp med en stråle av joniserad gas (argon eller väte).
Applicering och användning av acetylen:
- som råvara i kemisk industri för produktion av ättiksyra, etanol, lösningsmedel, plast, syntetisk gummi, aromatiska kolväten,
- för gassvetsning och skärning av metaller,
- för teknisk kol,
- som en källa till mycket ljus, vitt ljus i det autonoma lampor, där det erhålls genom reaktion mellan kalciumkarbid och vatten.
Explosivitet av acetylen och säkerhet vid hantering:
Acetylen har explosiva egenskaper.
Därför, behandling med acetylen kräver strikt efterlevnad av säkerhetsregler.
Acetylen brinner och exploderar även i frånvaro av syre och andra oxidationsmedel.
Blandningar av acetylen med luft är explosivt i ett mycket brett spektrum av koncentrationer.
En stråle av acetylensläpps ut i det fria, kan antändas från den minsta gnistan, inklusive urladdning av statisk elektricitet från fingret.
Vzryvaet acetylen beror på många faktorer: tryck, temperatur, renhet av acetylen, innehållet av fukt, förekomsten av katalysatorer och andra ämnen och andra orsaker.
Antändningstemperaturen för acetylen vid normalt - atmosfärstryck inom området 500-600 °C. När trycket minskar avsevärt antändningstemperaturen för acetylen. Således, vid ett tryck av 2 kgf / cm2 (0.2 MPa, 1,935682 Bankomat.) antändningstemperaturen för acetylen är lika med 630 °C. Och med ett tryck på 22 kgf / cm2 (2.2 MPa, 21,292502 Bankomat.) antändningstemperaturen för acetylen lika med 350 °C.
Närvaron av acetylen av partiklar av olika ämnen ökar ytkontakten och minskar därmed antändningstemperaturen vid atmosfärstryck. Till exempel, aktivt kol sänker antändningstemperaturen för acetylen till 400 °C, hydratet av järnoxid (rost) - upp till 280-300 °C, järnspån - upp till 520 °C, mässingsspån upp till 500-520 °C, karbid av kalcium, upp till 500 °C, aluminiumoxid - upp till 490 °C, kopparspån - 460 °C, järnoxiden - 280 °C, kopparoxid upp till 250 °C.
Explosivitet av acetylen minskar med utspädning av acetylen med andra gaser, till exempel kväve, metan eller propan.
Under vissa förhållanden reagerar acetylen med koppar, silver- och kvicksilver för att bilda explosiva föreningar. Därför, vid tillverkning av acetylenutrustning (t.ex., ventiler, cylindrar) Använd inte legeringarinnehåller mer än 70 % Cu.
Lagring och transport av acetylen, med specialstålcylindrar vit färg (med en röd inskription “A”) fylld med en inert porös material (t.ex., träkol). Således acetylen lagras och transporteras i dessa påsar i form av en lösning av acetylen i aceton under tryck av 1.5-2.5 MPa.
Notera: © Foto //www.pexels.com, //Pixabay.com



