Acetileno, preparação, propriedades, reações químicas

Acetileno, preparação, propriedades, e reações químicas.
Acetileno, C2H2 - classe de matéria orgânica, alcinos, hidrocarbonetos insaturados.
Acetileno, Fórmula, gás, especificações, características
Propriedades físicas do acetileno
Propriedades químicas do acetileno
Produção de acetileno na indústria e laboratórios
Reação química - equação acetileno
A aplicação e uso de acetileno
Explosividade do acetileno e segurança no manuseio
Acetileno, Fórmula, gás, recursos:
Acetileno (também - jene) - aula de matéria orgânica, alcinos, insaturado Hidrocarbonetosconsistindo em dois átomos de carbono e dois átomos de hidrogênio.
O químico fórmula de acetileno é C2H2. Fórmula estrutural de acetileno, CH≡CH. Isomers não tem.
A estrutura da molécula de acetileno:
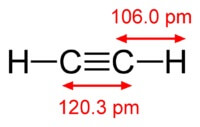
Acetileno tem uma ligação tripla entre átomos de carbono.
Acetileno - um gás incolor, sem gosto e cheiro. Contudo, o acetileno técnico contém impurezas - fósforo hidrogênio, sulfato de hidrogênio, etc., que dão um cheiro pungente.
Mais fácil ar. Densidade em comparação com a densidade do ar de 0.9.
Muito inflamável gás. Inflamável e explosivo.
Acetileno está entre os poucos compostos, combustão e explosão que são possíveis na ausência de oxigênio ou outros agentes oxidantes.
Misturas de acetileno com ar é explosivo em uma ampla gama de concentrações. Os riscos de explosão são reduzidos quando o acetileno diluído com outros gases, por exemplo azoto, metano ou propano.
Acetileno requer muito cuidado no manuseio. Pode explodir de choque, quando aquecido para 500 ° C ou quando comprimido acima 0.2 MPa à temperatura ambiente. Um fluxo de acetileno liberado no exterior ar, pode acender a partir da menor faísca, incluindo descarga de eletricidade estática do dedo. Armazenamento de acetileno usando cilindrospreenchido com material poroso embebido em acetona. O acetileno é armazenado em solução com acetona.
Ligeiramente solúvel em água. Muito solúvel em acetona. Solúvel em outras substâncias orgânicas (Gasolina, benzeno, etc.)
Acetileno tem um leve efeito tóxico.
Propriedades físicas do acetileno:
| Nome do parâmetro: | Valor: |
| Cor | sem cor |
| O cheiro | inodoro |
| Gosto | sem gosto |
| Estado agregado (em 20 ° C e pressão atmosférica de 1 ATM.) | gás |
| Densidade (em 20 ° C e pressão atmosférica de 1 ATM.) kg / m3 | 1,0896 |
| Densidade (em 0 ° C e pressão atmosférica de 1 ATM.) kg / m3 | 1,173 |
| Ponto de fusão, ° C | -80,8 |
| Ponto de ebulição, ° C | -80,55 |
| Ponto Triplo, ° C | 335 |
| A temperatura de autoignição, ° C | 335 |
| A pressão de autoignição, MPa | 0,14-0,16 |
| Temperatura critica*, ° C | Do 35.94 |
| Pressão crítica, MPa | 6,26 |
| Concentração explosiva da mistura de gás com ar, % por volume | 2.1 para 100 |
| Calor específico de combustão, MJ / kg | 56,9 |
| Temperatura da chama, ° C | 3150-3200 |
| Massa molar, g / mol | 26,038 |
* em temperaturas acima da temperatura crítica o gás não pode ser condensado a qualquer pressão.
Propriedades químicas do acetileno:
As propriedades químicas do acetileno são semelhantes às propriedades de outros representantes de uma série de alcinos. Portanto, é caracterizado pelas seguintes reações químicas:
1. galogenirovannami acetileno:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometano);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabromoetano).
A reação prossegue por etapas com a formação de derivados de alcanos.
Durante esta reação, acetileno descolorir bromo água.
2. acetileno hidrohalogenação:
CH≡CH + HBr → CH2 = CHBr (bromato).
3. hidratação de acetileno (reação Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldeído ) (kat = HgSO4, Hg(N ° 3)2).
4. trimerização de acetileno (reação Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzeno) (kat = carvão ativado, para = 450-500 OS).
A reação de trimerização do acetileno é um caso especial da reação de polimerização de acetileno ocorre ao passar acetileno sobre ativado carvão a uma temperatura de 450-500 OS.
5. dimerização de acetileno:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (obtido vinil acetileno) (kat = solução aquosa de CuCl e NH 4 CL).
A reação de dimerização do acetileno é um caso especial da reação de polimerização de acetileno.
6. a combustão do acetileno:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
O acetileno queima com uma chama branca brilhante.
7. a oxidação do acetileno.
A reação e seus produtos são determinados pelo ambiente em que ocorre.
8. recuperação de acetileno:
CH≡CH + H2 → C2H4 (etileno) (kat = Ni, Pd ou Pt, aumentado para);
CH≡CH + 2H2 → C2H6 (etano) (kat = Ni, Pd ou Pt, aumentado para).
Produção de acetileno na indústria e no laboratório. Reação química - equação acetileno:
Acetileno no laboratório é o resultado das seguintes reações químicas:
1. a ação da água sobre o carboneto de cálcio:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. desidrogenação de metano:
2CH4 → C2H2 + 3H2 (sujeito a > 1500 OC).
3. desidrogenação de etileno:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, para = 400-600 ° C).
Acetileno na indústria receba das seguintes maneiras e métodos:
4. método de carboneto:
Primeiro pegue cal do carbonato de cálcio.
CaCO3 → alto + CO2. (para = 900-1200 oC).
Então pegue um carboneto de cálcio, fusão óxido de cálcio e coque em um forno elétrico a uma temperatura de 2500-3000 ° C.
Alto + 3C → CaC2 + CO. (para = 2500-3000 OS).
Mais longe, carboneto de cálcio é tratado com água em uma reação conhecida.
CaC2 + H2O → CA(Oh)2 + C2H2.
O resultado é um acetileno de alta pureza 99.9 %.
5. craqueamento de metano em alta temperatura:
O craqueamento do metano a alta temperatura é realizado de acordo com a reação degidrirovaniya conhecida do metano em um forno elétrico a arco a uma temperatura de 2000-3000 ° C e uma tensão entre os eletrodos de 1000 V. a saída de acetileno é 50 %.
6. os vários modos de pirólise do metano:
Um tipo de craqueamento de metano em alta temperatura é a pirólise regenerativa (Processo Wulff), pirólise oxidativa (Processo Sachs ou processo BASF), pirólise homogênea, pirólise no meio de baixa temperatura plasma.
portanto, durante a pirólise regenerativa, primeiro queime o metano e aqueça o bocal da fornalha para 1350-1400 ° C. Em seguida, através de um bico aquecido para cortar o fluxo de metano, formando assim acetileno.
No decurso da pirólise oxidativa do metano é misturado com oxigênio e queimado. O calor resultante serve para aquecer o restante do metano para 1600 ° C, qual digidrive em acetileno. O rendimento do acetileno é 30-32 %.
Durante a pirólise homogênea de metano e oxigênio é queimado em uma fornalha a uma temperatura de 2000 ° C. Então, pré-aquecido para 600 ° C, o restante do metano é passado pela fornalha, formando assim acetileno.
Durante a pirólise em um ambiente de baixa temperatura plasma metano é aquecido por um jato de gás ionizado (argônio ou hidrogênio).
A aplicação e uso de acetileno:
- como matéria-prima na indústria química para a produção de ácido acético, Álcool etílico, solventes, plásticos, sintético borrachas, Hidrocarbonetos aromáticos,
- para soldagem a gás e corte de metais,
- para técnico carbono,
- como uma fonte de muito brilhante, luz branca no Autônomo lâmpadas, onde é obtido pela reação de carboneto de cálcio e água.
Explosividade do acetileno e segurança no manuseio:
Acetileno tem propriedades explosivas.
Portanto, tratamento com acetileno requer o cumprimento estrito das regras de segurança.
Acetileno queima e explode mesmo na ausência de oxigênio e outros agentes oxidantes.
Misturas de acetileno com ar são explosivo em uma ampla gama de concentrações.
Um jato de acetilenolançado ao ar livre, pode acender a partir da menor faísca, incluindo descarga de eletricidade estática do dedo.
Acetileno Vzryvaet depende de muitos fatores: pressão, temperatura, pureza de acetileno, o conteúdo de umidade, a presença de catalisadores e outras substâncias e outros motivos.
A temperatura de ignição do acetileno em normal - pressão atmosférica na faixa 500-600 ° C. Quando a pressão diminui significativamente a temperatura de ignição do acetileno. portanto, a uma pressão de 2 kgf / cm2 (0.2 MPa, 1,935682 ATM.) a temperatura de ignição do acetileno é igual a 630 ° C. E a uma pressão de 22 kgf / cm2 (2.2 MPa, 21,292502 ATM.) a temperatura de ignição do acetileno igual a 350 ° C.
A presença de acetileno de partículas de diferentes substâncias aumenta o contato da superfície e, assim, reduz a temperatura de ignição à pressão atmosférica. Por exemplo, o carvão ativado reduz a temperatura de ignição do acetileno para 400 ° C, o hidrato de óxido de ferro (ferrugem) - até 280-300 ° C, aparas de ferro - até 520 ° C, aparas de latão até 500-520 ° C, carboneto de cálcio, até 500 ° C, óxido de alumínio - até 490 ° C, aparas de cobre - 460 ° C, o óxido de ferro - 280 ° C, óxido de cobre até 250 ° C.
Explosividade do acetileno diminui com a diluição do acetileno com outro gases, por exemplo nitrogênio, metano ou propano.
Sob certas condições, o acetileno reage com cobre, prata e mercúrio para formar compostos explosivos. Portanto, na fabricação de equipamentos de acetileno (por exemplo., válvulas, cilindros) não use ligascontendo mais de 70 % Com.
Armazenamento e transporte de acetileno, usando cilindros de aço especial de cor branca (com uma inscrição vermelha “UMA”) preenchido com um poroso inerte material (por exemplo., carvão). portanto acetileno é armazenado e transportado nestes sacos na forma de uma solução de acetileno em acetona sob pressão de 1.5-2.5 MPa.
Nota: © Photo //www.pexels.com, //pixabay.com



