Acetylen, forberedelse, eiendommer, kjemiske reaksjoner

Acetylen, forberedelse, eiendommer, og kjemiske reaksjoner.
Acetylen, C2H2 - organisk materiale klasse, alkyner, umettede hydrokarboner.
Acetylen, formel, gass, spesifikasjoner, kjennetegn
Fysiske egenskaper til acetylen
Kjemiske egenskaper til acetylen
Produksjon av acetylen i industri og laboratorier
Kjemisk reaksjon - ligning acetylen
Eksplosivitet av acetylen og sikkerhet ved håndtering
Acetylen, formel, gass, egenskaper:
Acetylen (også - jene) - klasse for organisk materiale, alkyner, umettet hydrokarbonbestående av to karbonatomer og to hydrogenatomer.
Kjemikaliet formelen av acetylen er C2H2. Strukturformel av acetylen, CH≡CH. Isomers har ikke.
Strukturen til acetylenmolekylet:
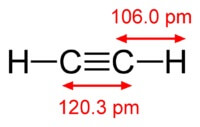
Acetylen har en trippelbinding mellom atomer av karbon.
Acetylen - en fargeløs gass, uten smak og lukt. derimot, den tekniske acetylen inneholder urenheter - fosfor hydrogen, hydrogensulfid, etc., som gir den en skarp lukt.
Lettere luft. Tetthet sammenlignet med tettheten av luften av 0.9.
En veldig brannfarlig gass. Brannfarlig og eksplosiv.
Acetylen er blant de få forbindelsene, forbrenning og eksplosjon som er mulig i fravær av oksygen eller andre oksidasjonsmidler.
Blandinger av acetylen med luft er eksplosivt i et veldig bredt spekter av konsentrasjoner. Eksplosjonsfare reduseres når fortynnet acetylen andre gasser, for eksempel nitrogen, metan eller propan.
Acetylen krever stor forsiktighet ved håndtering. Kan eksplodere av sjokk, når den varmes opp til 500 ° C eller når komprimert ovenfor 0.2 MPa ved romtemperatur. En strøm av acetylen som slippes ut utendørs luft, kan antennes fra den minste gnisten, inkludert statisk elektrisitetsutladning fra fingeren. Oppbevaring av acetylen ved bruk av spesial sylinderefylt med porøst materiale dynket med aceton. De acetylen lagres i oppløsning med aceton.
Litt løselig i vann. Svært løselig i aceton. Løselig i andre organiske stoffer (bensin, benzen, etc.)
Acetylen har en liten giftig effekt.
Fysiske egenskaper til acetylen:
| Parameternavn: | Verdi: |
| Farge | uten farge |
| Lukten | luktfri |
| Smak | ingen smak |
| Samlet tilstand (på 20 ° C og atmosfæretrykk på 1 Minibank.) | gass |
| Tetthet (på 20 ° C og atmosfæretrykk på 1 Minibank.) kg / m3 | 1,0896 |
| Tetthet (på 0 ° C og atmosfæretrykk på 1 Minibank.) kg / m3 | 1,173 |
| Smeltepunkt, ° C | -80,8 |
| Kokepunkt, ° C | -80,55 |
| Trippel punkt, ° C | 335 |
| Selvantennelsestemperaturen, ° C | 335 |
| Selvantennelsestrykket, MPa | 0,14-0,16 |
| Kritisk temperatur *, ° C | Av 35.94 |
| Kritisk press, MPa | 6,26 |
| Eksplosiv konsentrasjon av blandingen av gass og luft, % i volum | 2.1 til 100 |
| Spesifikk forbrenningsvarme, MJ / kg | 56,9 |
| Flammetemperatur, ° C | 3150-3200 |
| Molarmasse, g / mol | 26,038 |
* ved temperaturer over den kritiske temperaturen gassen kan ikke kondenseres under noe trykk.
Kjemiske egenskaper til acetylen:
Kjemiske egenskaper til acetylen er lik egenskapene til andre representanter for et antall alkyner. Så det er preget av følgende kjemiske reaksjoner:
1. galogenirovannami acetylen:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometan);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabrometan).
Reaksjonen fortsetter trinnvis med dannelse av derivater av alkaner.
Under denne reaksjonen, acetylen misfarget brom vann.
2. hydrohalogenering acetylen:
CH≡CH + HBr → CH2 = CHBr (bromat).
3. hydrering av acetylen (reaksjon Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldehyd ) (kat = HgSO4, Hg(NO3)2).
4. trimerisering av acetylen (reaksjon Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzen) (kat = aktivert karbon, til = 450-500 DE).
Reaksjonen av trimering av acetylen er et spesielt tilfelle av reaksjonen av polymerisering av acetylen oppstår ved å passere acetylen over aktivert kull ved en temperatur på 450-500 DE.
5. dimerisering av acetylen:
CH≡CH + CH2CH → CH2 = CH-C2CH (oppnådd vinylacetylen) (kat = vandig løsning av CuCl og NH 4 CL).
Reaksjonen av dimerisering av acetylen er et spesielt tilfelle av reaksjonen av polymerisering av acetylen.
6. forbrenningen av acetylen:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Acetylen brenner med en hvit lys flamme.
7. oksidasjonen av acetylen.
Reaksjonen og dens produkter bestemmes av miljøet den forekommer i.
8. utvinning av acetylen:
CH≡CH + H2 → C2H4 (etylen) (kat = Ni, Pd eller Pt, økt til);
CH≡CH + 2H2 → C2H6 (etan) (kat = Ni, Pd eller Pt, økt til).
Produksjon av acetylen i industrien og laboratoriet. Kjemisk reaksjon - ligning acetylen:
Acetylen i laboratoriet er resultatet av følgende kjemiske reaksjoner:
1. virkningen av vann på kalsiumkarbid:
CaC2 + H2O → CA(Åh)2 + C2H2.
2. dehydrogenering av metan:
2CH4 → C2H2 + 3H2 (underlagt > 1500 OC).
3. dehydrogenering av etylen:
CH2 = CH2 → CH2CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, til = 400-600 ° C).
Acetylen i bransjen motta på følgende måter og metoder:
4. karbidmetoden:
Først får du kalk fra kalsiumkarbonat.
CaCO3 → Høy + CO2. (til = 900-1200 oC).
Så skaff deg et karbid av kalsium, smelting kalsiumoksid og koks i en elektrisk ovn ved en temperatur på 2500-3000 ° C.
Høy + 3C → CaC2 + CO. (til = 2500-3000 DE).
Lengre, kalsiumkarbid behandles med vann ved en kjent reaksjon.
CaC2 + H2O → CA(Åh)2 + C2H2.
Resultatet er et acetylen med høy renhet er 99.9 %.
5. høy temperatur krakking av metan:
Høy temperatur krakking av metan utføres i henhold til kjent reaksjon degidrirovaniya av metan i en elektrisk lysbueovn ved en temperatur på 2000-3000 ° C og en spenning mellom elektrodene på 1000 V. produksjonen av acetylen er 50 %.
6. de forskjellige metodene for pyrolyse av metan:
En type høy temperatur krakking av metan er regenerativ pyrolyse (Wulff prosess), oksidativ pyrolyse (Sachs-prosess eller BASF-prosess), homogen pyrolyse, pyrolyse i mediet med lav temperatur plasma.
Og dermed, under den regenerative pyrolysen først brenne metan og varme opp dysen av ovnen til 1350-1400 ° C. Deretter gjennom en oppvarmet dyse for å kutte strømmen av metan, og danner derved acetylen.
I løpet av oksidativ blanding blandes pyrolyse av metan med oksygen og brennes. Den resulterende varmen tjener til å varme opp resten av metanet til 1600 ° C, som digidrive i acetylen. Utbyttet av acetylen er 30-32 %.
Under den homogene pyrolysen av metan og oksygen blir det brent inn en ovn ved en temperatur på 2000 ° C. Deretter, forvarmet til 600 ° C, resten av metanet føres gjennom ovnen, og danner derved acetylen.
Under pyrolyse i et miljø med lav temperatur plasma metan varmes opp med en stråle med ionisert gass (argon eller hydrogen).
Påføring og bruk av acetylen:
- som råvare i den kjemiske industrien for produksjon av eddiksyre, etyl alkohol, løsningsmidler, plast, syntetisk gummi, aromatiske hydrokarboner,
- for gassveising og skjæring av metaller,
- for teknisk karbon,
- som en kilde til veldig lys, hvitt lys i det autonome lamper, hvor det oppnås ved omsetning av kalsiumkarbid og vann.
Eksplosivitet av acetylen og sikkerhet ved håndtering:
Acetylen har eksplosive egenskaper.
Derfor, behandling med acetylen krever streng overholdelse av sikkerhetsregler.
Acetylen brenner og eksploderer selv i fravær av oksygen og andre oksidasjonsmidler.
Blandinger av acetylen og luft er eksplosivt i et veldig bredt spekter av konsentrasjoner.
En stråle av acetylensluppet ut i det fri, kan antennes fra den minste gnisten, inkludert statisk elektrisitetsutladning fra fingeren.
Vzryvaet acetylen avhenger av mange faktorer: press, temperatur, renhet av acetylen, innholdet av fuktighet, tilstedeværelsen av katalysatorer og andre stoffer og andre årsaker.
Antennelsestemperaturen for acetylen ved normalt - atmosfærisk trykk i området 500-600 ° C. Når trykket synker betydelig antennelsestemperaturen for acetylen. Og dermed, ved et trykk på 2 kgf / cm2 (0.2 MPa, 1,935682 Minibank.) antenningstemperaturen til acetylen er lik 630 ° C. Og ved et trykk på 22 kgf / cm2 (2.2 MPa, 21,292502 Minibank.) antennelsestemperaturen for acetylen lik 350 ° C.
Tilstedeværelsen av acetylen av partikler av forskjellige stoffer øker overflatekontakten og reduserer dermed antenningstemperaturen ved atmosfæretrykk. For eksempel, aktivt karbon senker antenningstemperaturen til acetylen til 400 ° C, hydratet av jernoksid (rust) - opp til 280-300 ° C, jernspon - opp til 520 ° C, messingspon opp til 500-520 ° C, karbid av kalsium, opp til 500 ° C, aluminiumoksid - opp til 490 ° C, kobberspon - 460 ° C, jernoksydet - 280 ° C, kobberoksid opp til 250 ° C.
Eksplosivitet av acetylen avtar med fortynning av acetylen med annet gasser, for eksempel nitrogen, metan eller propan.
Under visse forhold reagerer acetylen med kobber, sølv og kvikksølv for å danne eksplosive forbindelser. Derfor, i produksjonen av acetylenutstyr (f.eks., ventiler, sylindere) ikke bruk legeringerinneholder mer enn 70 % Med.
Lagring og transport av acetylen, bruker spesielle stålsylindere hvit farge (med rød påskrift “EN”) fylt med en inert porøs materiale (f.eks., kull). Og dermed acetylen lagres og transporteres i disse posene i form av en løsning av acetylen i aceton under trykk av 1.5-2.5 MPa.
Merk: © Foto //www.pexels.com, //Pixabay.com



