Acetyleen, voorbereiding, eigendommen, chemische reacties

Acetyleen, voorbereiding, eigendommen, en chemische reacties.
Acetyleen, C2H2 - organische stofklasse, alkynen, onverzadigde koolwaterstoffen.
Acetyleen, formule, gas-, specificaties, kenmerken
Fysische eigenschappen van acetyleen
Chemische eigenschappen van acetyleen
Productie van acetyleen in industrie en laboratoria
Chemische reactie - vergelijking acetyleen
De toepassing en het gebruik van acetyleen
Explosiviteit van acetyleen en veiligheid bij het hanteren
Acetyleen, formule, gas-, Kenmerken:
Acetyleen (ook - jene) - organische stof klasse, alkynen, onverzadigd koolwaterstofbestaande uit twee koolstofatomen en twee waterstofatomen.
De chemische stof formule van acetyleen is C2H2. Structuurformule van acetyleen, CH≡CH. Isomeren heeft dat niet.
De structuur van acetyleenmolecuul:
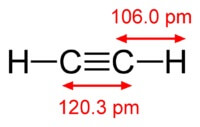
Acetyleen heeft een drievoudige binding tussen atomen van koolstof.
Acetyleen - een kleurloos gas, zonder smaak en geur. echter, het technische acetyleen bevat onzuiverheden - fosfor waterstof, waterstofsulfide, enzovoort., die het een scherpe geur geven.
Makkelijker lucht. Dichtheid vergeleken met de dichtheid van de lucht van 0.9.
Een zeer brandbaar gas-. Ontvlambaar en explosief.
Acetyleen is een van de weinige verbindingen, verbranding en explosie die mogelijk is bij afwezigheid zuurstof of andere oxidatiemiddelen.
Mengsels van acetyleen met lucht is explosief in een zeer breed concentratiegebied. Explosiegevaar wordt verminderd wanneer acetyleen en andere gassen worden verdund, bijvoorbeeld stikstof-, methaan of propaan.
Acetyleen vereist grote zorg bij het hanteren. Kan ontploffen door schokken, bij verhitting tot 500 ° C of wanneer hierboven gecomprimeerd 0.2 MPa bij kamertemperatuur. Een stroom acetyleen komt vrij in de buitenlucht lucht, kan ontbranden vanaf de kleinste vonk, inclusief ontlading van statische elektriciteit van de vinger. Opslag van acetyleen met behulp van speciaal cilindersgevuld met poreus materiaal gedrenkt in aceton. Ze acetyleen wordt opgeslagen in oplossing met aceton.
Enigszins oplosbaar in water. Zeer goed oplosbaar in aceton. Oplosbaar in andere organische stoffen (benzine, benzeen, enzovoort.)
Acetyleen heeft een licht toxisch effect.
Fysische eigenschappen van acetyleen:
| Parameternaam: | Waarde: |
| Kleur | zonder kleur |
| De geur | geurloos |
| Smaak | geen smaak |
| Geaggregeerde staat (Bij 20 ° C en atmosferische druk van 1 GELDAUTOMAAT.) | gas- |
| Dichtheid (Bij 20 ° C en atmosferische druk van 1 GELDAUTOMAAT.) kg / m3 | 1,0896 |
| Dichtheid (Bij 0 ° C en atmosferische druk van 1 GELDAUTOMAAT.) kg / m3 | 1,173 |
| Smeltpunt, °C | -80,8 |
| Kookpunt, °C | -80,55 |
| Drievoudig punt, °C | 335 |
| De zelfontbrandingstemperatuur, °C | 335 |
| De zelfontbrandingsdruk, MPa | 0,14-0,16 |
| Kritische temperatuur*, °C | Van 35.94 |
| Kritische druk, MPa | 6,26 |
| Explosieve concentratie van het gasmengsel met lucht, % op volume | 2.1 naar 100 |
| Specifieke verbrandingswarmte, MJ / kg | 56,9 |
| Vlam temperatuur, °C | 3150-3200 |
| Molaire massa, g / mol | 26,038 |
* bij temperaturen boven de kritische temperatuur het gas kan bij geen enkele druk worden gecondenseerd.
Chemische eigenschappen van acetyleen:
Chemische eigenschappen van acetyleen zijn vergelijkbaar met eigenschappen van andere vertegenwoordigers van een aantal alkynen. Het wordt dus gekenmerkt door de volgende chemische reacties:
1. galogenirovannami-acetyleen:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibromethaan);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabroomethaan).
De reactie verloopt in fasen met de vorming van derivaten van alkanen.
Tijdens deze reactie, acetyleen verkleurt broom water.
2. hydrohalogenering acetyleen:
CH≡CH + HBr → CH2 = CHBr (bromaat).
3. hydratatie van acetyleen (reactie Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (aceetaldehyde ) (kat = HgSO4, Hg(NUMMER 3)2).
4. trimerisatie van acetyleen (reactie Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzeen) (kat = actieve kool, naar = 450-500 DE).
De reactie van de trimerisatie van acetyleen is een speciaal geval van de reactie van polymerisatie van acetyleen treedt op door acetyleen overactief te leiden houtskool bij een temperatuur van 450-500 DE.
5. dimerisatie van acetyleen:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (verkregen vinylacetyleen) (kat = waterige oplossing van CuCl en NH 4 CL).
De reactie van dimerisatie van acetyleen is een speciaal geval van de reactie van polymerisatie van acetyleen.
6. de verbranding van acetyleen:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Acetyleen brandt met een witte heldere vlam.
7. de oxidatie van acetyleen.
De reactie en zijn producten worden bepaald door de omgeving waarin het plaatsvindt.
8. herstel van acetyleen:
CH≡CH + H2 → C2H4 (ethyleen) (kat = Ni, Pd of Pt, toegenomen tot);
CH≡CH + 2H2 → C2H6 (ethaan) (kat = Ni, Pd of Pt, toegenomen tot).
Productie van acetyleen in de industrie en het laboratorium. Chemische reactie - vergelijking acetyleen:
Acetyleen in het laboratorium is het resultaat van de volgende chemische reacties:
1. de werking van water op calciumcarbide:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. dehydrogenering van methaan:
2CH4 → C2H2 + 3H2 (onderworpen aan > 1500 OC).
3. dehydrogenering van ethyleen:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, naar = 400-600 °C).
Acetyleen in de industrie ontvangen op de volgende manieren en methoden:
4. carbide methode:
Haal eerst kalk uit calciumcarbonaat.
CaCO3 → Hoog + CO2. (naar = 900-1200 oC).
Koop dan een hardmetaal van calcium, versmelten calcium oxide en cokes in een elektrische oven bij een temperatuur van 2500-3000 °C.
Hoog + 3C → CaC2 + CO. (naar = 2500-3000 DE).
Verder, calciumcarbide wordt behandeld met water bij een bekende reactie.
CaC2 + H2O → CA(Oh)2 + C2H2.
Het resultaat is een acetyleen met een hoge zuiverheid 99.9 %.
5. kraken van methaan op hoge temperatuur:
Kraken van methaan bij hoge temperatuur wordt uitgevoerd volgens de bekende reactie degidrirovaniya van methaan in een vlamboogoven bij een temperatuur van 2000-3000 ° C en een spanning tussen de elektroden van 1000 V. de output van acetyleen is 50 %.
6. de verschillende manieren van pyrolyse van methaan:
Een soort van hoge temperatuur kraken van methaan is regeneratieve pyrolyse (Wulff-proces), oxidatieve pyrolyse (Sachs-proces of BASF-proces), homogene pyrolyse, pyrolyse in het medium van lage temperatuur plasma.
Dus, verbrand tijdens de regeneratieve pyrolyse eerst methaan en verwarmde het mondstuk van de oven naar 1350-1400 °C. Vervolgens door een verwarmd mondstuk om de methaanstroom af te sluiten, waardoor acetyleen wordt gevormd.
In de loop van oxidatieve pyrolyse wordt methaan gemengd met zuurstof en verbrand. De resulterende warmte dient om de rest van het methaan te verwarmen 1600 °C, die digidrive in acetyleen. De opbrengst aan acetyleen is 30-32 %.
Tijdens de homogene pyrolyse wordt methaan en zuurstof verbrand een oven bij een temperatuur van 2000 °C. Vervolgens, voorverwarmd tot 600 °C, de rest van het methaan wordt door de oven geleid, waardoor acetyleen wordt gevormd.
Tijdens pyrolyse in een omgeving met lage temperatuur plasma methaan wordt verwarmd door een straal geïoniseerd gas (argon of waterstof).
De toepassing en het gebruik van acetyleen:
- als grondstof in de chemische industrie voor de productie van azijnzuur, ethylalcohol, oplosmiddelen, kunststoffen, synthetisch rubbers, Aromatische koolwaterstoffen,
- voor gaslassen en snijden van metalen,
- voor technisch koolstof,
- als een bron van zeer helder, wit licht in de Autonomous lampen, waar het wordt verkregen door de reactie van calciumcarbide en water.
Explosiviteit van acetyleen en veiligheid bij het hanteren:
Acetyleen heeft explosieve eigenschappen.
Daarom, behandeling met acetyleen vereist strikte naleving van veiligheidsregels.
Acetyleen brandt en explodeert, zelfs in afwezigheid van zuurstof en andere oxidatiemiddelen.
Mengsels van acetyleen met lucht is explosief in een zeer breed concentratiegebied.
Een straal acetyleenvrijgegeven in de open lucht, kan ontbranden vanaf de kleinste vonk, inclusief ontlading van statische elektriciteit van de vinger.
Vzryvaet acetyleen hangt van veel factoren af: druk, temperatuur-, zuiverheid van acetyleen, het gehalte aan vocht, de aanwezigheid van katalysatoren en andere stoffen en andere redenen.
De ontbrandingstemperatuur van acetyleen bij normaal - atmosferische druk in het bereik 500-600 °C. Wanneer de druk de ontstekingstemperatuur van acetyleen aanzienlijk daalt. Dus, bij een druk van 2 kgf / cm2 (0.2 MPa, 1,935682 GELDAUTOMAAT.) de ontstekingstemperatuur van acetyleen is gelijk aan 630 °C. En onder druk van 22 kgf / cm2 (2.2 MPa, 21,292502 GELDAUTOMAAT.) de ontstekingstemperatuur van acetyleen gelijk aan 350 °C.
De aanwezigheid van acetyleen van deeltjes van verschillende stoffen verhoogt het oppervlaktecontact en verlaagt zo de ontstekingstemperatuur bij atmosferische druk. Bijvoorbeeld, actieve kool verlaagt de ontbrandingstemperatuur van acetyleen tot 400 °C, het hydraat van ijzeroxide (Roest) - tot 280-300 °C, ijzerschaafsel - tot 520 °C, messing krullen tot 500-520 °C, carbide van calcium, tot 500 °C, aluminiumoxide - tot 490 °C, koper krullen - 460 °C, het ijzeroxide - 280 °C, koperoxide tot 250 °C.
Explosiviteit van acetyleen neemt af met verdunning van acetyleen met andere gassen, bijvoorbeeld stikstof, methaan of propaan.
Acetyleen reageert onder bepaalde omstandigheden koper, zilver en kwik om explosieve verbindingen te vormen. Daarom, bij de vervaardiging van acetyleenapparatuur (bijv., kleppen, cilinders) gebruik niet legeringenmet meer dan 70 % Met.
Opslag en transport van acetyleen, met behulp van speciale stalen cilinders in witte kleur (met een rode inscriptie “EEN”) gevuld met een inert poreus materiaal (bijv., houtskool). Dus acetyleen wordt opgeslagen en vervoerd in deze zakken in de vorm van een oplossing van acetyleen in aceton onder druk van 1.5-2.5 MPa.
Notitie: © Foto //www.pexels.com, //pixabay.com



