아세틸렌, 예비, 속성, 화학 반응

아세틸렌, 예비, 속성, 및 화학 반응.
아세틸렌, C2H2 – 유기물 등급, 알킨, 불포화 탄화수소.
아세틸렌, 공식, 가스, 풍모:
아세틸렌 (또한 – 제네) – 유기물 등급, 알킨, 불포화 탄화수소두 개의 탄소 원자와 두 개의 수소 원자로 구성.
화학 아세틸렌의 공식은 C2H2. 아세틸렌의 구조식, CH≡CH. 이성질체는.
아세틸렌 분자의 구조:
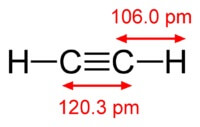
아세틸렌 원자 사이에 삼중 결합이있다 탄소의.
아세틸렌 – 무색 가스, 맛과 냄새없이. 하지만, 기술적 인 아세틸렌은 불순물을 포함합니다 – 인 수소, 황화수소, 기타, 매운 냄새가 나는.
더 쉬움 공기. 밀도 대비 밀도 공기의 NS 0.9.
매우 가연성 가스. 가연성 및 폭발성.
아세틸렌 몇 가지 화합물 중 하나입니다, 부재시 가능한 연소 및 폭발 산소의 또는 기타 산화제.
아세틸렌과 공기 매우 광범위한 농도에서 폭발적입니다.. 희석 된 아세틸렌 기타 가스로 폭발 위험이 감소합니다., 예를 들면 질소, 메탄 또는 프로판.
아세틸렌 취급에 많은주의가 필요합니다. 충격으로 폭발 할 수 있음, 가열하면 500 ° C 또는 위에서 압축했을 때 0.2 실온에서 MPa. 실외로 방출되는 아세틸렌의 흐름 공기, 가장 작은 불꽃에서 발화 할 수 있음, 손가락의 정전기 방전 포함. 특수를 이용한 아세틸렌 저장 실린더아세톤을 적신 다공성 물질로 채워짐. 아세틸렌은 아세톤과 함께 용액에 저장됩니다..
약간 용해 됨 물. 아세톤에 잘 용해 됨. 다른 유기 물질에 가용 (가솔린, 벤젠, 기타)
아세틸렌 약간의 독성 효과가 있습니다.
아세틸렌의 물리적 특성:
| 매개 변수 이름: | 값: |
| 색깔 | 무색 |
| 냄새 | 냄새 없는 |
| 맛이 나다 | 맛이 없다 |
| 집계 상태 (...에서 20 ° C 및 대기압 1 ATM.) | 가스 |
| 밀도 (...에서 20 ° C 및 대기압 1 ATM.) kg / m3 | 1,0896 |
| 밀도 (...에서 0 ° C 및 대기압 1 ATM.) kg / m3 | 1,173 |
| 녹는 점, ° C | -80,8 |
| 비점, ° C | -80,55 |
| 트리플 포인트, ° C | 335 |
| 자동 점화 온도, ° C | 335 |
| 자동 점화 압력, MPa | 0,14-0,16 |
| 임계 온도 *, ° C | 의 35.94 |
| 임계 압력, MPa | 6,26 |
| 가스와 공기 혼합물의 폭발적인 농도, % 부피로 | 2.1 ...에 100 |
| 연소의 비열, MJ / kg | 56,9 |
| 화염 온도, ° C | 3150-3200 |
| 몰 질량, g / mol | 26,038 |
* 임계 온도 이상의 온도에서 가스 어떤 압력에서도 응축 될 수 없음.
아세틸렌의 화학적 성질:
아세틸렌의 화학적 특성은 여러 알킨의 다른 대표자의 특성과 유사합니다.. 따라서 다음과 같은 화학 반응이 특징입니다:
1. 갈로 게 니로 반 나미 아세틸렌:
CH≡CH + Br2 → CHBr = CHBr (1,2-디 브로 메탄);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-테트라 브로 모에 탄).
반응은 유도체의 형성과 함께 단계적으로 진행됩니다. 알칸.
이 반응 동안, 아세틸렌 변색 브롬 물.
2. 하이드로 할로겐화 아세틸렌:
CH≡CH + HBr → CH2 = CHBr (브롬산염).
3. 아세틸렌의 수화 (반응 마이클 G. 쿠체 로프, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (에놀) → CH3-CH = O (아세트 알데히드 ) (kat = HgSO4, HG(NO3)2).
4. 아세틸렌의 삼량 체화 (반응 Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (벤젠) (kat = 활성탄, 에 = 450-500 그만큼).
아세틸렌의 삼량 체화 반응은 반응의 특별한 경우입니다 아세틸렌의 중합 아세틸렌을 활성화 된 숯 의 온도에서 450-500 그만큼.
5. 아세틸렌의 이량 체화:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (얻어진 비닐 아세틸렌) (kat = CuCl과 NH의 수용액 4 CL).
아세틸렌의 이량 체화 반응은 반응의 특별한 경우입니다 아세틸렌의 중합.
6. 아세틸렌의 연소:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
아세틸렌은 흰색의 밝은 불꽃으로 연소됩니다..
7. 아세틸렌의 산화.
반응과 그 생성물은 그것이 일어나는 환경에 의해 결정됩니다.
8. 아세틸렌 회수:
CH≡CH + H2 → C2H4 (에틸렌) (kat = Ni, Pd 또는 Pt, 증가);
CH≡CH + 2H2 → C2H6 (에탄) (kat = Ni, Pd 또는 Pt, 증가).
산업 및 실험실에서 아세틸렌 생산. 화학 반응 – 방정식 아세틸렌:
아세틸렌 실험실에서 다음과 같은 화학 반응의 결과입니다:
1. 칼슘 카바이드에 대한 물의 작용:
CaC2 + H2O → CA(오)2 + C2H2.
2. 메탄의 탈수 소화:
2CH4 → C2H2 + 3H2 (대상 > 1500 OC).
3. 에틸렌의 탈수 소화:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, 에 = 400-600 ° C).
아세틸렌 업계에서 다음과 같은 방법과 방법으로 수신:
4. 초경 방법:
먼저 탄산 칼슘에서 석회를 얻으십시오..
CaCO3 → 높음 + 이산화탄소. (에 = 900-1200 oC).
그런 다음 카바이드를 칼슘, 융합 산화 칼슘 전기로에서 코크스를 2500-3000 ° C.
높은 + 3C → CaC2 + 뭐라고 요. (에 = 2500-3000 그만큼).
더욱이, 칼슘 카바이드 처리 물로 알려진 반응으로.
CaC2 + H2O → CA(오)2 + C2H2.
그 결과 고순도의 아세틸렌은 99.9 %.
5. 메탄의 고온 균열:
메탄의 고온 분해는 다음의 온도에서 전기 아크로에서 메탄의 알려진 반응 degidrirovaniya에 따라 수행됩니다. 2000-3000 ° C 및 전극 사이의 전압 1000 V. 아세틸렌의 출력은 50 %.
6. 메탄의 다양한 열분해 모드:
메탄의 고온 균열은 재생 열분해입니다. (울프 프로세스), 산화 열분해 (Sachs 프로세스 또는 BASF 프로세스), 균질 열분해, 저온 매질에서의 열분해 혈장.
그러므로, 재생 열분해 중 먼저 메탄을 태우고 노즐을 가열 용광로 ...에 1350-1400 ° C. 그런 다음 가열 된 노즐을 통해 메탄의 흐름을 차단합니다., 따라서 아세틸렌을 형성.
메탄의 산화 열분해 과정에서 산소와 혼합되어 연소됩니다.. 결과 열은 나머지 메탄을 가열하여 1600 ° C, 아세틸렌의 디지 드라이브. 아세틸렌의 수율은 30-32 %.
메탄과 산소의 균질 한 열분해 과정에서 용광로 의 온도에서 2000 ° C. 그때, 예열 600 ° C, 나머지 메탄은 용광로를 통과합니다., 따라서 아세틸렌을 형성.
저온 환경에서 열분해 중 혈장 메탄은 이온화 된 가스 분사로 가열됩니다. (아르곤 또는 수소).
아세틸렌의 응용 및 사용:
– 아세트산 생산을위한 화학 산업의 원료, 에틸 알코올, 용매, 플라스틱, 인조 덧신, 방향족 탄화수소,
– 가스 용접 및 금속 절단 용,
– 기술 탄소,
– 매우 밝은 소스로, Autonomous의 백색광 램프, 칼슘 카바이드와 물의 반응으로 얻어지는 곳.
아세틸렌의 폭발성 및 취급 안전성:
아세틸렌 폭발성이있다.
따라서, 아세틸렌 치료 안전 규칙을 엄격히 준수해야합니다..
아세틸렌 산소 및 기타 산화제가없는 경우에도 화상 및 폭발.
아세틸렌과 공기의 혼합물은 매우 광범위한 농도에서 폭발성.
아세틸렌 분사야외로 방출, 가장 작은 불꽃에서 발화 할 수 있음, 손가락의 정전기 방전 포함.
Vzryvaet 아세틸렌 많은 요인에 따라 달라집니다: 압력, 온도, 아세틸렌의 순도, 수분 함량, 촉매 및 기타 물질의 존재 및 기타 이유.
아세틸렌의 발화 온도 정상 – 대기압 범위 500-600 ° C. 압력이 아세틸렌의 발화 온도를 현저히 낮추는 경우. 그러므로, 압력에 2 kgf / cm2 (0.2 MPa, 1,935682 ATM.) 아세틸렌의 점화 온도는 다음과 같습니다. 630 ° C. 그리고 압력에 22 kgf / cm2 (2.2 MPa, 21,292502 ATM.) 아세틸렌의 발화 온도는 350 ° C.
다른 물질 입자의 아세틸렌이 있으면 표면 접촉이 증가하여 대기압에서 점화 온도가 감소합니다.. 예를 들면, 활성탄은 아세틸렌의 점화 온도를 낮춰 400 ° C, 산화철의 수화물 (녹) - 까지 280-300 ° C, 철분 부스러기 – 최대 520 ° C, 최대 황동 부스러기 500-520 ° C, 칼슘의 탄화물, 까지 500 ° C, 산화 알루미늄 – 최대 490 ° C, 구리 부스러기 – 460 ° C, 산화철 – 280 ° C, 최대 구리 산화물 250 ° C.
아세틸렌의 폭발성 아세틸렌의 희석으로 감소 가스, 예를 들어 질소, 메탄 또는 프로판.
특정 조건에서 아세틸렌은 구리, 은 과 수은 폭발성 화합물 형성. 따라서, 아세틸렌 장비 제조 (예 :, 밸브, 실린더) 사용하지 마세요 합금이상 포함 70 % 와.
아세틸렌 저장 및 운송, 특수 강철 실린더 흰색 사용 (빨간 비문이있는 “ㅏ”) 불활성 다공성으로 채워진 재료 (예 :, 숯). 그러므로 아세틸렌은 저장되고 운반됩니다 압력 하에서 아세톤에 아세틸렌 용액의 형태 로이 가방에 1.5-2.5 MPa.
노트: © 사진 //www.pexels.com, //pixabay.com



