アセチレン, 準備, プロパティ, 化学反応

アセチレン, 準備, プロパティ, と化学反応.
アセチレン, C2H2 –有機物クラス, アルキン, 不飽和炭化水素.
アセチレン, 式, ガス, 特徴:
アセチレン (また– jene) –有機物クラス, アルキン, 不飽和 炭化水素2つの炭素原子と2つの水素原子で構成されています.
化学物質 アセチレンの式は C2H2. アセチレンの構造式, CH≡CH. 異性体はしていません.
アセチレン分子の構造:
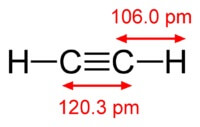
アセチレン 原子間に三重結合があります 炭素の.
アセチレン –無色のガス, 味も匂いもない. しかしながら, 技術的なアセチレンには不純物が含まれています–リン 水素, 硫化水素, 等, 刺激臭がする.
より簡単に 空気. 密度と比較した密度 空気の の 0.9.
非常に可燃性 ガス. 可燃性および爆発性.
アセチレン 数少ない化合物の1つです, 不在下で可能な燃焼と爆発 酸素の または他の酸化剤.
アセチレンとの混合物 空気 非常に広範囲の濃度で爆発性. アセチレンの他のガスを希釈すると、爆発の危険性が減少します, 例えば 窒素, メタン または プロパン.
アセチレン 取り扱いには細心の注意が必要です. 感電により爆発する可能性があります, に加熱すると 500 °Cまたは上で圧縮した場合 0.2 室温でMPa. 屋外に放出されたアセチレンの流れ 空気, 最小の火花から発火することができます, 指からの静電気放電を含む. 特殊なアセチレンの貯蔵 シリンダーアセトンを染み込ませた多孔質材料で満たされている. それらのアセチレンはアセトンとの溶液で保存されます.
やや溶けやすい 水. アセトンに非常に溶ける. 他の有機物質に可溶 (ガソリン, ベンゼン, 等)
アセチレン わずかな毒性作用があります.
アセチレンの物性:
| パラメータ名: | 値: |
| 色 | 色なし |
| におい | 無臭 |
| 味 | 味がない |
| 集約状態 (で 20 °Cと大気圧 1 ATM。) | ガス |
| 密度 (で 20 °Cと大気圧 1 ATM。) kg / m3 | 1,0896 |
| 密度 (で 0 °Cと大気圧 1 ATM。) kg / m3 | 1,173 |
| 融点, °C | -80,8 |
| 沸点, °C | -80,55 |
| 三重点, °C | 335 |
| 自己発火温度, °C | 335 |
| 自己発火圧力, MPa | 0,14-0,16 |
| 臨界温度*, °C | の 35.94 |
| 臨界圧力, MPa | 6,26 |
| ガスと空気の混合物の爆発性濃度, % ボリュームで | 2.1 に 100 |
| 比熱, MJ / kg | 56,9 |
| 火炎温度, °C | 3150-3200 |
| モル質量, g / mol | 26,038 |
* 臨界温度を超える温度で ガス どの圧力でも凝縮できません.
アセチレンの化学的性質:
アセチレンの化学的性質は、多くのアルキンの他の代表的な性質と類似しています。. したがって、それは次の化学反応によって特徴付けられます:
1. ガロゲニロバンナミアセチレン:
CH≡CH + Br2→CHBr = CHBr (1,2-ジブロモメタン);
CHBr = CHBr + Br2→CHBr2-CHBr2 (1,1,2,2-テトラブロモエタン).
反応は段階的に進行し、誘導体が形成されます。 アルカンの.
この反応の間, アセチレン変色臭素 水.
2. ハロゲン化水素化アセチレン:
CH≡CH + HBr→CH2 = CHBr (臭素酸塩).
3. アセチレンの水和 (反応マイケルG. クチェロフ, 1881):
CH≡CH + H2O→ [CH2 = CH-OH] (エノール) →CH3-CH = O (アセトアルデヒド ) (kat = HgSO4, 水銀(NO3)2).
4. アセチレンの三量体化 (反応ニコラヤDmitrievichazelinskogo, 1927):
3СН≡CH→C6H6 (ベンゼン) (kat =活性炭, to = 450-500 THE).
アセチレンの三量体化の反応は、反応の特殊なケースです アセチレンの重合 活性化された上にアセチレンを通過させることによって発生します 木炭 の温度で 450-500 THE.
5. アセチレンの二量体化:
CH≡CH + CH≡CH→CH2 =CH-C≡CH (得られたビニルアセチレン) (kat = CuClとNHの水溶液 4 CL).
アセチレンの二量化反応は、反応の特殊なケースです。 アセチレンの重合.
6. アセチレンの燃焼:
2SN≡CH + 5О2→4СО2 + 2Н2О.
アセチレンは白い明るい炎で燃えます.
7. アセチレンの酸化.
反応とその生成物は、それが発生する環境によって決定されます.
8. アセチレンの回収:
CH≡CH + H2→C2H4 (エチレン) (kat = Ni, PdまたはPt, に増加しました);
CH≡CH + 2H2→C2H6 (エタン) (kat = Ni, PdまたはPt, に増加しました).
産業および実験室でのアセチレンの生産. 化学反応–方程式アセチレン:
アセチレン 研究室で 以下の化学反応の結果です:
1. 炭化カルシウムに対する水の作用:
CaC2 + H2O→CA(ああ)2 + C2H2.
2. メタンの脱水素:
2CH4→C2H2 + 3H2 (対象 > 1500 OC).
3. エチレンの脱水素:
CH2 = CH2→CH≡CH+ H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 400-600 °C).
アセチレン 業界で 次の方法と方法で受け取ります:
4. 超硬法:
最初に炭酸カルシウムから石灰を得る.
CaCO3→高 + CO2. (to = 900-1200 oC).
次に、カーバイドを取得します カルシウムの, フュージング 酸化カルシウム と電気炉でコークス 2500-3000 °C.
CaO + 3C→CaC2 + CO. (to = 2500-3000 THE).
さらに, 炭化カルシウムが処理されます 水で 既知の反応で.
CaC2 + H2O→CA(ああ)2 + C2H2.
その結果、高純度のアセチレンが得られます。 99.9 %.
5. メタンの高温分解:
メタンの高温分解は、電気アーク炉内でのメタンの既知の反応degidrirovaniyaに従って、 2000-3000 °Cと電極間の電圧 1000 V. アセチレンの出力は 50 %.
6. メタンの熱分解のさまざまなモード:
メタンの高温分解の一種は再生熱分解です (ウルフプロセス), 酸化的熱分解 (Sachs-プロセスまたはBASFプロセス), 均一熱分解, 低温媒体での熱分解 プラズマ.
したがって、, 再生熱分解中に最初にメタンを燃焼させ、ノズルを加熱します 炉の に 1350-1400 °C. 次に、加熱されたノズルを通してメタンの流れを遮断します, それによりアセチレンを形成します.
メタンの酸化的熱分解の過程で、酸素と混合されて燃焼します. 結果として生じる熱は、メタンの残りをに加熱するのに役立ちます 1600 °C, アセチレンのどのdigidrive. アセチレンの収量は 30-32 %.
メタンと酸素の均一な熱分解の間に燃やされます かまど の温度で 2000 °C. 次に, に予熱 600 °C, 残りのメタンは炉を通過します, それによりアセチレンを形成します.
低温環境での熱分解中 プラズマ メタンはイオン化ガスのジェットによって加熱されます (アルゴン または 水素).
アセチレンの用途と使用:
–酢酸生産のための化学産業の原料として, エチルアルコール, 溶剤, プラスチック, 合成 ゴム, 芳香族炭化水素,
–ガス溶接および金属切断用,
–技術用 炭素,
–非常に明るい光源として, 自律型の白色光 ランプ, 炭化カルシウムと水の反応によって得られる場所.
アセチレンの爆発性と取り扱いの安全性:
アセチレン 爆発性がある.
したがって、, アセチレンによる治療 安全規則を厳守する必要があります.
アセチレン 酸素やその他の酸化剤がなくても火傷や爆発を起こす.
アセチレンと空気の混合物は 非常に広範囲の濃度で爆発性.
アセチレンのジェット野外に放たれる, 最小の火花から発火することができます, 指からの静電気放電を含む.
Vzryvaetアセチレン 多くの要因に依存します: 圧力, 温度, アセチレンの純度, 水分の含有量, 触媒および他の物質の存在および他の理由.
アセチレンの発火温度 通常–範囲内の大気圧 500-600 °C. 圧力がアセチレンの発火温度を大幅に下げるとき. したがって、, の圧力で 2 kgf / cm2 (0.2 MPa, 1,935682 ATM。) アセチレンの発火温度はに等しい 630 °C. そしての圧力で 22 kgf / cm2 (2.2 MPa, 21,292502 ATM。) アセチレンの発火温度は 350 °C.
異なる物質の粒子のアセチレンの存在は、表面接触を増加させ、したがって大気圧での発火温度を低下させます. 例えば, 活性炭はアセチレンの発火温度を 400 °C, 酸化鉄の水和物 (さび) –まで 280-300 °C, 鉄の削りくず–最大 520 °C, 真鍮の削りくずまで 500-520 °C, カルシウムの炭化物, まで 500 °C, 酸化アルミニウム–最大 490 °C, 銅の削りくず– 460 °C, 酸化鉄– 280 °C, 酸化銅まで 250 °C.
アセチレンの爆発性 アセチレンを他のもので希釈すると減少します ガス, 例えば窒素, メタンまたはプロパン.
特定の条件下で、アセチレンはと反応します 銅, 銀 そして 水星 爆発性化合物を形成する. したがって、, アセチレン装置の製造において (例えば, バルブ, シリンダー) 使ってはいけません 合金以上を含む 70 % と.
アセチレンの保管と輸送, 特殊鋼ボンベを使用した白色 (赤い碑文と “A”) 不活性多孔質で満たされている 素材 (例えば, 木炭). したがって、 アセチレンは貯蔵され、輸送されます これらのバッグの中で、アセトン中のアセチレンの溶液の形で、 1.5-2.5 MPa.
注意: ©写真//www.pexels.com, //pixabay.com



