Acetilene, preparazione, proprietà, reazioni chimiche

Acetilene, preparazione, proprietà, e reazioni chimiche.
Acetilene, C2H2 - classe di materia organica, alchini, idrocarburi insaturi.
Acetilene, formula, gas, specifiche, caratteristiche
Proprietà fisiche dell'acetilene
Proprietà chimiche dell'acetilene
Produzione di acetilene nell'industria e nei laboratori
Reazione chimica - equazione acetilene
L'applicazione e l'uso dell'acetilene
Esplosività dell'acetilene e sicurezza nella manipolazione
Acetilene, formula, gas, Caratteristiche:
Acetilene (anche - jene) - classe di materia organica, alchini, insaturi idrocarburocostituito da due atomi di carbonio e due atomi di idrogeno.
La chimica la formula dell'acetilene è C2H2. Formula strutturale di acetilene, CH≡CH. Gli isomeri no.
La struttura della molecola di acetilene:
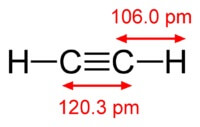
Acetilene ha un triplo legame tra gli atomi di carbonio.
Acetilene - un gas incolore, senza sapore e odore. tuttavia, l'acetilene tecnico contiene impurità - fosforo idrogeno, idrogeno solforato, eccetera., che gli danno un odore pungente.
Più facile aria. Densità rispetto alla densità dell'aria di 0.9.
Un molto infiammabile gas. Infiammabile ed esplosivo.
Acetilene è tra i pochi composti, combustione ed esplosione che è possibile in assenza di ossigeno o altri agenti ossidanti.
Miscele di acetilene con aria è esplosivo in una gamma molto ampia di concentrazioni. I rischi di esplosione sono ridotti quando si diluisce l'acetilene con altri gas, per esempio azoto, metano o propano.
Acetilene richiede grande cura nella manipolazione. Può esplodere per shock, quando riscaldato a 500 ° C o quando compressa sopra 0.2 MPa a temperatura ambiente. Un flusso di acetilene rilasciato all'esterno aria, può accendersi dalla più piccola scintilla, compresa la scarica di elettricità statica dal dito. Conservazione di acetilene utilizzando speciali cilindririempito con materiale poroso imbevuto di acetone. L'acetilene viene conservato in soluzione con acetone.
Leggermente solubile in acqua. Molto solubile in acetone. Solubile in altre sostanze organiche (benzina, benzene, eccetera.)
Acetilene ha un leggero effetto tossico.
Proprietà fisiche dell'acetilene:
| Nome del parametro: | Valore: |
| Colore | senza colore |
| L'odore | inodore |
| Gusto | senza sapore |
| Stato aggregato (a 20 ° C e pressione atmosferica di 1 ATM.) | gas |
| Densità (a 20 ° C e pressione atmosferica di 1 ATM.) kg / m3 | 1,0896 |
| Densità (a 0 ° C e pressione atmosferica di 1 ATM.) kg / m3 | 1,173 |
| Punto di fusione, °C | -80,8 |
| Punto di ebollizione, °C | -80,55 |
| Punto triplo, °C | 335 |
| La temperatura di autoaccensione, °C | 335 |
| La pressione di autoaccensione, MPa | 0,14-0,16 |
| Temperatura critica*, °C | Di 35.94 |
| Pressione critica, MPa | 6,26 |
| Concentrazione esplosiva della miscela di gas con aria, % in volume | 2.1 per 100 |
| Calore specifico di combustione, MJ / kg | 56,9 |
| Temperatura della fiamma, °C | 3150-3200 |
| Massa molare, g / mol | 26,038 |
* a temperature superiori alla temperatura critica il gas non può essere condensato a nessuna pressione.
Proprietà chimiche dell'acetilene:
Le proprietà chimiche dell'acetilene sono simili a proprietà di altri rappresentanti di parecchi alchini. Quindi è caratterizzato dalle seguenti reazioni chimiche:
1. galogenirovannami acetilene:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometano);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabromoetano).
La reazione procede per fasi con la formazione dei derivati di alcani.
Durante questa reazione, l'acetilene scolorisce il bromo acqua.
2. idroalogenazione acetilene:
CH≡CH + HBr → CH2 = CHBr (bromato).
3. idratazione dell'acetilene (reazione Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldeide ) (kat = HgSO4, Hg(NUMERO 3)2).
4. trimerizzazione dell'acetilene (reazione Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzene) (kat = carbone attivo, a = 450-500 IL).
La reazione della trimerizzazione dell'acetilene è un caso speciale della reazione di polimerizzazione dell'acetilene si verifica passando l'acetilene sopra attivato carbone a una temperatura di 450-500 IL.
5. dimerizzazione dell'acetilene:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (ottenuto vinilacetilene) (kat = soluzione acquosa di CuCl e NH 4 CL).
La reazione di dimerizzazione dell'acetilene è un caso speciale della reazione di polimerizzazione dell'acetilene.
6. la combustione dell'acetilene:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
L'acetilene brucia con una fiamma bianca brillante.
7. l'ossidazione dell'acetilene.
La reazione e i suoi prodotti sono determinati dall'ambiente in cui si verifica.
8. recupero di acetilene:
CH≡CH + H2 → C2H4 (etilene) (kat = Ni, Pd o Pt, aumentato a);
CH≡CH + 2H2 → C2H6 (etano) (kat = Ni, Pd o Pt, aumentato a).
Produzione di acetilene nell'industria e in laboratorio. Reazione chimica - equazione acetilene:
Acetilene in laboratorio è il risultato delle seguenti reazioni chimiche:
1. l'azione dell'acqua sul carburo di calcio:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. deidrogenazione del metano:
2CH4 → C2H2 + 3H2 (soggetto a > 1500 OC).
3. deidrogenazione dell'etilene:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, a = 400-600 °C).
Acetilene nell'industria ricevere nei seguenti modi e metodi:
4. metodo al carburo:
Per prima cosa prendi la calce dal carbonato di calcio.
CaCO3 → Alto + CO2. (a = 900-1200 oC).
Quindi prendi un carburo di calcio, fusione ossido di calcio e coke in un forno elettrico a una temperatura di 2500-3000 °C.
Alto + 3C → CaC2 + CHE COSA. (a = 2500-3000 IL).
Ulteriore, viene trattato il carburo di calcio con acqua a una reazione nota.
CaC2 + H2O → CA(Oh)2 + C2H2.
Il risultato è un acetilene di elevata purezza 99.9 %.
5. cracking ad alta temperatura del metano:
Il cracking ad alta temperatura del metano viene effettuato secondo la nota reazione degidrirovaniya del metano in un forno ad arco elettrico a una temperatura di 2000-3000 ° C e una tensione tra gli elettrodi di 1000 V. la produzione di acetilene è 50 %.
6. le varie modalità di pirolisi del metano:
Un tipo di cracking ad alta temperatura del metano è la pirolisi rigenerativa (Processo di Wulff), pirolisi ossidativa (Processo Sachs o processo BASF), pirolisi omogenea, pirolisi nel mezzo di bassa temperatura plasma.
Così, durante la pirolisi rigenerativa bruciare prima metano e riscaldare l'ugello della fornace per 1350-1400 °C. Quindi attraverso un ugello riscaldato per interrompere il flusso del metano, formando così acetilene.
Nel corso della pirolisi ossidativa il metano viene miscelato con ossigeno e bruciato. Il calore risultante serve a riscaldare il resto del metano 1600 °C, quale digidrive in acetilene. La resa in acetilene è 30-32 %.
Durante la pirolisi omogenea di metano e ossigeno viene bruciato una fornace a una temperatura di 2000 °C. Poi, preriscaldato a 600 °C, il resto del metano viene fatto passare attraverso il forno, formando così acetilene.
Durante la pirolisi in un ambiente a bassa temperatura plasma il metano viene riscaldato da un getto di gas ionizzato (argon o idrogeno).
L'applicazione e l'uso dell'acetilene:
- come materia prima nell'industria chimica per la produzione di acido acetico, alcol etilico, solventi, plastica, sintetico gomme, idrocarburi aromatici,
- per saldatura a gas e taglio metalli,
- per tecnico carbonio,
- come fonte di molto luminoso, luce bianca in Autonoma lampade, dove è ottenuto per reazione di carburo di calcio e acqua.
Esplosività dell'acetilene e sicurezza nella manipolazione:
Acetilene ha proprietà esplosive.
Perciò, trattamento con acetilene richiede il rispetto rigoroso delle norme di sicurezza.
Acetilene brucia ed esplode anche in assenza di ossigeno e altri agenti ossidanti.
Le miscele di acetilene con l'aria sono esplosivo in una gamma molto ampia di concentrazioni.
Un getto di acetilenerilasciato all'aria aperta, può accendersi dalla più piccola scintilla, compresa la scarica di elettricità statica dal dito.
Vzryvaet acetilene dipende da molti fattori: pressione, temperatura, purezza dell'acetilene, il contenuto di umidità, la presenza di catalizzatori e altre sostanze e altri motivi.
La temperatura di accensione dell'acetilene a normale - pressione atmosferica nell'intervallo 500-600 °C. Quando la pressione diminuisce notevolmente la temperatura di accensione dell'acetilene. Così, ad una pressione di 2 kgf / cm2 (0.2 MPa, 1,935682 ATM.) la temperatura di accensione dell'acetilene è pari a 630 °C. E a una pressione di 22 kgf / cm2 (2.2 MPa, 21,292502 ATM.) la temperatura di accensione dell'acetilene pari a 350 °C.
La presenza di acetilene di particelle di diverse sostanze aumenta il contatto superficiale e quindi riduce la temperatura di accensione a pressione atmosferica. Per esempio, il carbone attivo abbassa la temperatura di accensione dell'acetilene a 400 °C, l'idrato di ossido di ferro (ruggine) - fino a 280-300 °C, trucioli di ferro - fino a 520 °C, trucioli di ottone fino a 500-520 °C, carburo di calcio, fino a 500 °C, ossido di alluminio - fino a 490 °C, trucioli di rame - 460 °C, l'ossido di ferro - 280 °C, ossido di rame fino a 250 °C.
Esplosività dell'acetilene diminuisce con la diluizione dell'acetilene con altri gas, per esempio azoto, metano o propano.
In certe condizioni l'acetilene reagisce con rame, argento e mercurio per formare composti esplosivi. Perciò, nella produzione di apparecchiature per l'acetilene (per esempio., valvole, cilindri) non usare leghecontenente più di 70 % Cu.
Stoccaggio e trasporto dell'acetilene, utilizzando speciali cilindri in acciaio colore bianco (con una scritta rossa “UN”) riempito con un inerte poroso Materiale (per esempio., carbone). Così l'acetilene viene immagazzinato e trasportato in queste sacche sotto forma di una soluzione di acetilene in acetone sotto pressione di 1.5-2.5 MPa.
Nota: © Foto //www.pexels.com, //pixabay.com


