Asetilen, persiapan, properti, reaksi kimia

Asetilen, persiapan, properti, dan reaksi kimia.
Asetilen, C2H2 - kelas bahan organik, alkuna, hidrokarbon tak jenuh.
Asetilen, rumus, gas, spesifikasi, karakteristik
Produksi asetilen di industri dan laboratorium
Reaksi kimia - persamaan asetilena
Aplikasi dan penggunaan asetilen
Ledakan asetilen dan keamanan dalam penanganan
Asetilen, rumus, gas, fitur:
Asetilen (juga - jene) - kelas bahan organik, alkuna, tak jenuh hidrokarbonterdiri dari dua atom karbon dan dua atom hidrogen.
Bahan kimia rumus asetilen adalah C2H2. Rumus struktur asetilena, CH≡CH. Isomer belum.
Struktur molekul asetilen:
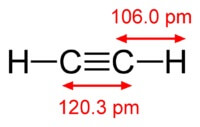
Asetilen memiliki ikatan rangkap tiga antar atom karbon.
Asetilen - gas tak berwarna, tanpa rasa dan bau. Namun, asetilen teknis mengandung kotoran - fosfor hidrogen, hidrogen sulfida, dll., yang memberikan bau menyengat.
Lebih mudah udara. Massa jenis dibandingkan dengan kepadatan di udara dari 0.9.
A sangat mudah terbakar gas. Mudah terbakar dan meledak.
Asetilen adalah di antara sedikit senyawa, pembakaran dan ledakan yang mungkin terjadi jika tidak ada oksigen atau zat pengoksidasi lainnya.
Campuran asetilen dengan udara bersifat eksplosif dalam kisaran konsentrasi yang sangat luas. Bahaya ledakan berkurang jika asetilen diencerkan dengan gas lain, sebagai contoh nitrogen, metana atau propana.
Asetilen membutuhkan perawatan yang baik dalam penanganannya. Bisa meledak karena shock, saat dipanaskan 500 ° C atau saat dikompresi di atas 0.2 MPa pada suhu kamar. Aliran asetilen dilepaskan ke luar ruangan udara, dapat menyala dari percikan terkecil, termasuk pelepasan listrik statis dari jari. Penyimpanan asetilen dengan menggunakan khusus silinderdiisi dengan bahan berpori yang direndam dengan aseton. Mereka asetilen disimpan dalam larutan dengan aseton.
Sedikit larut dalam air. Sangat larut dalam aseton. Larut dalam zat organik lainnya (bensin, benzena, dll.)
Asetilen memiliki sedikit efek toksik.
Sifat fisik asetilen:
| Nama parameter: | Nilai: |
| Warna | tanpa warna |
| Baunya | tidak berbau |
| Rasa | tidak ada rasa |
| Negara bagian agregat (di 20 ° C dan tekanan atmosfer 1 ATM.) | gas |
| Massa jenis (di 20 ° C dan tekanan atmosfer 1 ATM.) kg / m3 | 1,0896 |
| Massa jenis (di 0 ° C dan tekanan atmosfer 1 ATM.) kg / m3 | 1,173 |
| Titik lebur, ° C | -80,8 |
| Titik didih, ° C | -80,55 |
| Tiga poin, ° C | 335 |
| Suhu penyalaan otomatis, ° C | 335 |
| Tekanan penyalaan otomatis, MPa | 0,14-0,16 |
| Temperatur kritis*, ° C | Dari 35.94 |
| Tekanan kritis, MPa | 6,26 |
| Konsentrasi eksplosif dari campuran gas dengan udara, % berdasarkan volume | 2.1 untuk 100 |
| Panas spesifik dari pembakaran, MJ / kg | 56,9 |
| Suhu nyala api, ° C | 3150-3200 |
| Masa molar, g / mol | 26,038 |
* pada suhu di atas suhu kritis gas tidak dapat dipadatkan pada tekanan apa pun.
Sifat kimia asetilena:
Sifat kimia asetilena mirip dengan sifat perwakilan lain dari sejumlah alkuna. Jadi ini ditandai dengan reaksi kimia berikut:
1. galogenirovannami acetylene:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometana);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabromoetana).
Reaksi berlangsung secara bertahap dengan pembentukan turunan dari alkana.
Selama reaksi ini, asetilen menghitamkan brom air.
2. hidrohalogenasi asetilena:
CH≡CH + HBr → CH2 = CHBr (bromat).
3. hidrasi asetilena (reaksi Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (asetaldehida ) (kat = HgSO4, HG(NOMOR 3)2).
4. trimerisasi asetilena (reaksi Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzena) (kat = karbon aktif, untuk = 450-500 ITU).
Reaksi trimerisasi asetilena adalah kasus khusus dari reaksi polimerisasi asetilena terjadi dengan melewatkan asetilen selama diaktifkan arang pada suhu 450-500 ITU.
5. dimerisasi asetilena:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (memperoleh vinil asetilen) (kat = larutan CuCl dan NH dalam air 4 CL).
Reaksi dimerisasi asetilena adalah kasus khusus dari reaksi polimerisasi asetilena.
6. pembakaran asetilena:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Asetilen terbakar dengan nyala api putih terang.
7. oksidasi asetilena.
Reaksi dan produknya ditentukan oleh lingkungan tempat terjadinya.
8. pemulihan asetilen:
CH≡CH + H2 → C2H4 (etilen) (kat = Ni, Pd atau Pt, meningkat menjadi);
CH≡CH + 2H2 → C2H6 (etana) (kat = Ni, Pd atau Pt, meningkat menjadi).
Produksi asetilen di industri dan laboratorium. Reaksi kimia - persamaan asetilena:
Asetilen di laboratorium adalah hasil dari reaksi kimia berikut:
1. aksi air pada kalsium karbida:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. dehidrogenasi metana:
2CH4 → C2H2 + 3H2 (tunduk pada > 1500 OC).
3. dehidrogenasi etilen:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, untuk = 400-600 ° C).
Asetilen di industri terima dengan cara dan metode berikut:
4. metode karbida:
Pertama dapatkan jeruk nipis dari kalsium karbonat.
CaCO3 → Tinggi + CO2. (untuk = 900-1200 oC).
Lalu dapatkan karbida kalsium, sekering kalsium oksida dan kokas dalam tungku listrik pada suhu 2500-3000 ° C.
Tinggi + 3C → CaC2 + BERSAMA. (untuk = 2500-3000 ITU).
Lebih lanjut, kalsium karbida diobati dengan air pada reaksi yang diketahui.
CaC2 + H2O → CA(Oh)2 + C2H2.
Hasilnya adalah asetilen dengan kemurnian tinggi 99.9 %.
5. pemecahan metana bersuhu tinggi:
Perengkahan metana bersuhu tinggi dilakukan sesuai dengan reaksi yang diketahui degidrirovaniya metana dalam tungku busur listrik pada suhu 2000-3000 ° C dan tegangan antara elektroda 1000 V.. Output dari asetilena adalah 50 %.
6. berbagai mode pirolisis metana:
Jenis retakan metana suhu tinggi adalah pirolisis regeneratif (Proses wulff), pirolisis oksidatif (Proses Sachs atau proses BASF), pirolisis homogen, pirolisis dalam medium suhu rendah plasma.
Jadi, selama pirolisis regeneratif pertama-tama bakar metana dan panaskan nozel dari tungku untuk 1350-1400 ° C. Kemudian melalui nosel yang dipanaskan untuk memutus aliran metana, sehingga membentuk asetilen.
Dalam proses pirolisis oksidatif, metana dicampur dengan oksigen dan dibakar. Panas yang dihasilkan berfungsi untuk memanaskan sisa metana menjadi 1600 ° C, yang digidrive dalam asetilena. Hasil asetilen adalah 30-32 %.
Selama pirolisis homogen metana dan oksigen dibakar sebuah tungku pada suhu 2000 ° C. Kemudian, dipanaskan terlebih dahulu ke 600 ° C, sisa metana dilewatkan melalui tungku, sehingga membentuk asetilen.
Selama pirolisis di lingkungan bersuhu rendah plasma metana dipanaskan oleh semburan gas terionisasi (argon atau hidrogen).
Aplikasi dan penggunaan asetilen:
- sebagai bahan baku dalam industri kimia untuk produksi asam asetat, etil alkohol, pelarut, plastik, sintetis karet, hidrokarbon aromatik,
- untuk pengelasan gas dan memotong logam,
- untuk teknis karbon,
- sebagai sumber yang sangat cerah, cahaya putih di Autonomous lampu, dimana itu diperoleh dengan reaksi kalsium karbida dan air.
Ledakan asetilen dan keamanan dalam penanganan:
Asetilen memiliki sifat mudah meledak.
Karena itu, pengobatan dengan asetilen membutuhkan kepatuhan ketat terhadap aturan keselamatan.
Asetilen terbakar dan meledak bahkan tanpa oksigen dan zat pengoksidasi lainnya.
Campuran asetilen dengan udara sedang meledak dalam kisaran konsentrasi yang sangat luas.
Semburan asetilendilepaskan ke udara terbuka, dapat menyala dari percikan terkecil, termasuk pelepasan listrik statis dari jari.
Vzryvaet acetylene tergantung pada banyak faktor: tekanan, suhu, kemurnian asetilen, kandungan kelembaban, adanya katalis dan zat lain dan alasan lainnya.
Suhu penyalaan asetilena pada normal - tekanan atmosfer dalam kisaran 500-600 ° C. Ketika tekanan secara signifikan menurunkan suhu penyalaan asetilena. Jadi, pada tekanan 2 kgf / cm2 (0.2 MPa, 1,935682 ATM.) suhu penyalaan asetilena sama dengan 630 ° C. Dan dengan tekanan 22 kgf / cm2 (2.2 MPa, 21,292502 ATM.) suhu penyalaan asetilen sama dengan 350 ° C.
Kehadiran asetilen dari partikel zat yang berbeda meningkatkan kontak permukaan dan dengan demikian mengurangi suhu penyalaan pada tekanan atmosfer. Sebagai contoh, karbon aktif menurunkan suhu penyalaan asetilen menjadi 400 ° C, hidrat oksida besi (karat) - hingga 280-300 ° C, serutan besi - hingga 520 ° C, serutan kuningan hingga 500-520 ° C, karbida kalsium, hingga 500 ° C, aluminium oksida - hingga 490 ° C, serutan tembaga - 460 ° C, oksida besi - 280 ° C, oksida tembaga hingga 250 ° C.
Daya ledak asetilen menurun dengan pengenceran asetilen dengan lainnya gas, misalnya nitrogen, metana atau propana.
Dalam kondisi tertentu asetilen bereaksi dengan tembaga, perak dan air raksa untuk membentuk senyawa yang dapat meledak. Karena itu, dalam pembuatan peralatan asetilen (misalnya, katup, silinder) jangan gunakan paduanmengandung lebih dari 70 % Dengan.
Penyimpanan dan transportasi asetilen, menggunakan silinder baja khusus warna putih (dengan tulisan merah “SEBUAH”) diisi dengan porous inert bahan (misalnya, arang). Jadi asetilena disimpan dan diangkut dalam kantong ini dalam bentuk larutan asetilen dalam aseton di bawah tekanan 1.5-2.5 MPa.
Catatan: © Foto //www.pexels.com, //pixabay.com



