Acetilén, készítmény, tulajdonságait, kémiai reakciók

Acetilén, készítmény, tulajdonságait, és kémiai reakciók.
Acetilén, C2H2 - szerves anyag osztály, alkinek, telítetlen szénhidrogének.
Acetilén, képlet, gáz, specifikációk, jellemzők
Az acetilén fizikai tulajdonságai
Az acetilén kémiai tulajdonságai
Acetilén gyártása az iparban és a laboratóriumokban
Kémiai reakció - egyenlet acetilén
Az acetilén alkalmazása és felhasználása
Az acetilén robbanékonyságát és a kezelés biztonságát
Acetilén, képlet, gáz, jellemzők:
Acetilén (is - jene) - szervesanyag osztály, alkinek, telítetlen szénhidrogénkét szénatomból és két hidrogénatomból áll.
A vegyszer az acetilén képlete C2H2. Az acetilén szerkezeti képlete, CH≡CH. Az izomerek nem.
Az acetilén molekula szerkezete:
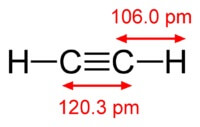
Acetilén hármas kötése van az atomok között szén.
Acetilén - színtelen gáz, íz és szag nélkül. azonban, a technikai acetilén szennyeződéseket tartalmaz - foszfort hidrogén, hidrogén-szulfid, stb., amelyek csípős szagot árasztanak neki.
Könnyebb levegő. Sűrűség a sűrűséghez képest a levegő nak,-nek 0.9.
Nagyon gyúlékony gáz. Gyúlékony és robbanásveszélyes.
Acetilén a kevés vegyület közé tartozik, égés és robbanás, amely távollétében lehetséges oxigén vagy más oxidálószerek.
Acetilén keveréke levegő nagyon széles koncentrációtartományban robbanásveszélyes. A hígított acetilén egyéb gázok esetén a robbanásveszély csökken, például nitrogén, metán vagy propán.
Acetilén nagy gondosságot igényel a kezelés során. Felrobbanhat a sokktól, amikor arra melegítik 500 ° C-on vagy ha magasabbra van nyomva 0.2 MPa szobahőmérsékleten. Az acetilén áram a szabadba engedett levegő, meggyulladhat a legkisebb szikrától, beleértve az ujjból származó statikus elektromosság kisülését. Az acetilén tárolása speciális felhasználással hengerekacetonnal átitatott porózus anyaggal töltve meg. Az acetilént acetonos oldatban tárolják.
Enyhén oldódik víz. Nagyon oldódik acetonban. Oldható más szerves anyagokban (benzin, benzol, stb.)
Acetilén enyhe mérgező hatása van.
Az acetilén fizikai tulajdonságai:
| Paraméter neve: | Érték: |
| Szín | szín nélkül |
| A szag | szagtalan |
| Íz | nincs íze |
| Összesített állapot (nál nél 20 ° C és a légköri nyomás 1 ATM.) | gáz |
| Sűrűség (nál nél 20 ° C és a légköri nyomás 1 ATM.) kg / m3 | 1,0896 |
| Sűrűség (nál nél 0 ° C és a légköri nyomás 1 ATM.) kg / m3 | 1,173 |
| Olvadáspont, ° C | -80,8 |
| Forráspont, ° C | -80,55 |
| Hármas pont, ° C | 335 |
| Öngyulladási hőmérséklet, ° C | 335 |
| Öngyulladási nyomás, MPa | 0,14-0,16 |
| Kritikus hőmérséklet *, ° C | Nak,-nek 35.94 |
| Kritikus nyomás, MPa | 6,26 |
| Robbanásveszélyes koncentrációja a levegő gázkeverékének, % térfogat szerint | 2.1 nak nek 100 |
| Fajlagos égési hő, MJ / kg | 56,9 |
| Láng hőmérséklete, ° C | 3150-3200 |
| Moláris tömeg, g / mol | 26,038 |
* a kritikus hőmérséklet feletti hőmérsékleten a gáz semmilyen nyomáson nem kondenzálható.
Az acetilén kémiai tulajdonságai:
Az acetilén kémiai tulajdonságai hasonlóak számos alkin más képviselőinek tulajdonságaihoz. Tehát a következő kémiai reakciók jellemzik:
1. galogenirovannami acetilén:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometán);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabróm-etán).
A reakció lépésenként halad tovább származékok képződésével alkánok.
E reakció során, acetilén elszíneződött bróm víz.
2. hidrogén-halogénező acetilén:
CH≡CH + HBr → CH2 = CHBr (bromát).
3. az acetilén hidratálása (reakció Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldehid ) (kat = HgSO4, Hg(NO3)2).
4. acetilén trimerizálása (reakció Nikolaja Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzol) (kat = aktív szén, hogy = 450-500 A).
Az acetilén trimerizálásának reakciója a reakció speciális esete az acetilén polimerizációja az acetilén aktivált felett történő áthaladásával történik faszén hőmérsékleten 450-500 A.
5. az acetilén dimerizálása:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (kapott vinil-acetilént) (kat = CuCl és NH vizes oldata 4 CL).
Az acetilén dimerizálásának reakciója a reakció speciális esete az acetilén polimerizációja.
6. az acetilén elégetése:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Az acetilén fehér fényes lánggal ég.
7. az acetilén oxidációja.
A reakciót és termékeit az a környezet határozza meg, amelyben zajlik.
8. az acetilén visszanyerése:
CH≡CH + H2 → C2H4 (etilén) (kat = Ni, Pd vagy Pt, -ra nőtt);
CH≡CH + 2H2 → C2H6 (etán) (kat = Ni, Pd vagy Pt, -ra nőtt).
Acetilén gyártása az iparban és a laboratóriumokban. Kémiai reakció - egyenlet acetilén:
Acetilén a laboratóriumban a következő kémiai reakciók eredménye:
1. a víz hatása a kalcium-karbidra:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. metán dehidrogénezése:
2CH4 → C2H2 + 3H2 (alá tartozik > 1500 OC).
3. az etilén dehidrogénezése:
CH2 = CH2 → CH2CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, hogy = 400-600 ° C).
Acetilén az iparban a következő módszerekkel és módszerekkel kapja meg:
4. keményfém módszer:
Először kalcium-karbonátból nyerj mészt.
CaCO3 → Magas + CO2. (hogy = 900-1200 oC).
Ezután szerezzen keményfémet kalcium, összeolvad kalcium-oxid és kokszot egy elektromos kemencében 2500-3000 ° C.
Magas + 3C → CaC2 + MIT. (hogy = 2500-3000 A).
További, kalcium-karbidot kezelünk vízzel ismert reakciónál.
CaC2 + H2O → CA(Oh)2 + C2H2.
Az eredmény egy nagy tisztaságú acetilén 99.9 %.
5. metán magas hőmérsékleten történő krakkolása:
A metán magas hőmérsékleten történő krakkolását ismert metidrán-degidrirovaniya szerint hajtják végre egy elektromos ívkemencében, kb. 2000-3000 ° C és az elektródák közötti feszültség 1000 V. az acetilén kibocsátása 50 %.
6. a metán pirolízisének különféle módjai:
A metán magas hőmérsékleten történő krakkolásának egyik típusa a regeneratív pirolízis (Wulff-folyamat), oxidatív pirolízis (Sachs-folyamat vagy BASF-folyamat), homogén pirolízis, pirolízis alacsony hőmérsékletű közegben vérplazma.
És így, a regeneratív pirolízis során először égessünk el metánt és melegítsük fel a fúvókát a kemence nak nek 1350-1400 ° C. Ezután egy fűtött fúvókán át a metán áramlásának elzárására, ezáltal acetilént képez.
Az oxidatív pirolízis során a metánt oxigénnel keverjük és elégetjük. Az így kapott hő a metán maradékának felmelegítésére szolgál 1600 ° C, amelyek digidrive acetilénben. Az acetilén hozama 10% 30-32 %.
A metán és az oxigén homogén pirolízise során beégnek kemence hőmérsékleten 2000 ° C. Azután, előmelegítve 600 ° C, a metán maradékát átengedik a kemencén, ezáltal acetilént képez.
Pirolízis közben alacsony hőmérsékletű környezetben vérplazma a metánt ionizált gáz sugárral melegítik (argon vagy hidrogén).
Az acetilén alkalmazása és felhasználása:
- mint alapanyag a vegyiparban ecetsav előállítására, etilalkohol, oldószerek, műanyagok, szintetikus gumik, aromás szénhidrogének,
- gázhegesztéshez és fémek vágásához,
- műszaki szén,
- nagyon fényes forrásként, fehér fény az Autonómban lámpák, ahol kalcium-karbid és víz reakciójával nyerik.
Az acetilén robbanékonyságát és a kezelés biztonságát:
Acetilén robbanásveszélyes tulajdonságokkal rendelkezik.
Ezért, acetilénnel végzett kezelés megköveteli a biztonsági szabályok szigorú betartását.
Acetilén ég és robban oxigén és egyéb oxidálószerek hiányában is.
Az acetilén és a levegő keveréke robbanásveszélyes koncentrációk nagyon széles tartományában.
Acetilén sugárszabadba engedve, meggyulladhat a legkisebb szikrától, beleértve az ujjból származó statikus elektromosság kisülését.
Vzryvaet acetilén sok tényezőtől függ: nyomás, hőfok, acetilén tisztasága, a nedvességtartalom, katalizátorok és egyéb anyagok jelenléte és egyéb okok.
Az acetilén gyulladási hőmérséklete normál - légköri nyomáson 500-600 ° C. Amikor a nyomás jelentősen csökkenti az acetilén gyulladási hőmérsékletét. És így, nyomáson 2 kgf / cm2 (0.2 MPa, 1,935682 ATM.) az acetilén gyulladási hőmérséklete megegyezik 630 ° C. És nyomáson 22 kgf / cm2 (2.2 MPa, 21,292502 ATM.) az acetilén gyulladási hőmérséklete egyenlő 350 ° C.
Különböző anyagok részecskéinek acetilén jelenléte növeli a felületi érintkezést, és ezáltal csökkenti a gyulladási hőmérsékletet légköri nyomáson. Például, az aktív szén az acetilén gyulladási hőmérsékletét alacsonyabbra csökkenti 400 ° C, a vas-oxid hidrátja (rozsda) - legfeljebb 280-300 ° C, vasforgács - legfeljebb 520 ° C, sárgaréz forgács 500-520 ° C, karbid kalcium, akár 500 ° C, alumínium-oxid - legfeljebb 490 ° C, réz forgács - 460 ° C, a vas-oxid - 280 ° C, réz-oxid legfeljebb 250 ° C.
Az acetilén robbanóképessége csökken az acetilén hígításával gázok, például nitrogén, metán vagy propán.
Bizonyos körülmények között az acetilén reagál réz, ezüst és higany robbanásveszélyes vegyületek képződéséhez. Ezért, acetilén berendezések gyártásában (például., szelepek, hengerek) ne használja ötvözetektöbb mint 70 % Val vel.
Az acetilén tárolása és szállítása, speciális acél hengerek fehér színű (piros felirattal “A”) inert porózus anyaggal töltve meg anyag (például., faszén). És így az acetilént tárolják és szállítják ezekben a tasakokban acetilén - aceton oldat formájában 1.5-2.5 MPa.
jegyzet: © Fotó //www.pexels.com, //pixabay.com



