Acetilen, priprema, Svojstva, kemijske reakcije

Acetilen, priprema, Svojstva, i kemijske reakcije.
Acetilen, C2H2 - klasa organske tvari, alkini, nezasićeni ugljikovodici.
Acetilen, formula, plin, tehnički podaci, karakteristike
Proizvodnja acetilena u industriji i laboratorijima
Kemijska reakcija - jednadžba acetilen
Eksplozivnost acetilena i sigurnost u rukovanju
Acetilen, formula, plin, značajke:
Acetilen (također - jene) - klasa organske tvari, alkini, nezasićen ugljikovodikkoji se sastoji od dva atoma ugljika i dva atoma vodika.
Kemijska formula acetilena je C2H2. Strukturna formula acetilena, CH≡CH. Izomeri nisu.
Građa molekule acetilena:
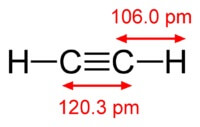
Acetilen ima trostruku vezu između atoma ugljika.
Acetilen - bezbojni plin, bez okusa i mirisa. Međutim, tehnički acetilen sadrži nečistoće - fosfor vodik, sumporovodik, itd., koji mu daju oštar miris.
Jednostavnije zrak. Gustoća u odnosu na gustoću zraka od 0.9.
Vrlo zapaljivo plin. Zapaljivo i eksplozivno.
Acetilen je među rijetkim spojevima, izgaranje i eksplozija što je moguće u odsutnosti kisika ili drugih oksidirajućih sredstava.
Smjese acetilena sa zrak je eksplozivan u vrlo širokom rasponu koncentracija. Opasnost od eksplozije smanjuje se kada se acetilen razrijedi ostalim plinovima, na primjer dušik, metan ili propan.
Acetilen zahtijeva veliku pažnju u rukovanju. Može eksplodirati od šoka, kad se zagrije na 500 ° C ili kada je komprimiran iznad 0.2 MPa na sobnoj temperaturi. Struja acetilena puštena u otvoreni prostor zrak, može se zapaliti od najmanje iskre, uključujući pražnjenje statičkog elektriciteta iz prsta. Skladištenje acetilena pomoću posebnih cilindriispunjen poroznim materijalom natopljenim acetonom. Oni acetilen se čuva u otopini s acetonom.
Malo topiv u voda. Vrlo topljiv u acetonu. Topivo u drugim organskim tvarima (benzin, benzen, itd.)
Acetilen ima lagani toksični učinak.
Fizička svojstva acetilena:
| Naziv parametra: | Vrijednost: |
| Boja | bez boje |
| Miris | bez mirisa |
| Ukus | bez okusa |
| Agregatno stanje (na 20 ° C i atmosferski tlak od 1 BANKOMAT.) | plin |
| Gustoća (na 20 ° C i atmosferski tlak od 1 BANKOMAT.) kg / m3 | 1,0896 |
| Gustoća (na 0 ° C i atmosferski tlak od 1 BANKOMAT.) kg / m3 | 1,173 |
| Talište, ° C | -80,8 |
| Vrelište, ° C | -80,55 |
| Trostruka točka, ° C | 335 |
| Temperatura samozapaljenja, ° C | 335 |
| Tlak samozapaljenja, MPa | 0,14-0,16 |
| Kritična temperatura *, ° C | Od 35.94 |
| Kritični pritisak, MPa | 6,26 |
| Eksplozivna koncentracija smjese plina sa zrakom, % po volumenu | 2.1 do 100 |
| Specifična toplina izgaranja, MJ / kg | 56,9 |
| Temperatura plamena, ° C | 3150-3200 |
| Molekulska masa, g / mol | 26,038 |
* na temperaturama iznad kritične temperature plin ne može se kondenzirati ni pod kakvim pritiskom.
Kemijska svojstva acetilena:
Kemijska svojstva acetilena slična su svojstvima drugih predstavnika niza alkina. Dakle, karakteriziraju ga sljedeće kemijske reakcije:
1. galogenirovannami acetilen:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometan);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabrometan).
Reakcija se odvija etapno s stvaranjem derivata alkana.
Tijekom ove reakcije, acetilen diskolor brom voda.
2. hidrohalogeniranje acetilen:
CH≡CH + HBr → CH2 = CHBr (bromate).
3. hidratacija acetilena (reakcija Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldehid ) (kat = HgSO4, Hg(H2O → Ca)2).
4. trimerizacija acetilena (reakcija Nikolaya Dmitrievicha zelinskogo, 1927):
3SN≡CH → C6H6 (benzen) (kat = aktivni ugljen, do = 450-500 THE).
Reakcija trimerizacije acetilena je poseban slučaj reakcije polimerizacije acetilena nastaje prelaskom acetilena preko aktiviranog ugljen na temperaturi od 450-500 THE.
5. dimerizacija acetilena:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (dobiven vinil acetilen) (kat = vodena otopina CuCl i NH 4 CL).
Poseban je slučaj reakcija dimerizacije acetilena polimerizacije acetilena.
6. izgaranje acetilena:
2SN≡CH + 5O2 → 4SO2 + 2N2O.
Acetilen gori bijelim svijetlim plamenom.
7. oksidacija acetilena.
Reakcija i njeni produkti određeni su okolinom u kojoj se ona događa.
8. oporaba acetilena:
CH≡CH + H2 → C2H4 (etilen) (kat = Ni, Pd ili Pt, povećana na);
CH≡CH + 2H2 → C2H6 (etan) (kat = Ni, Pd ili Pt, povećana na).
Proizvodnja acetilena u industriji i laboratoriju. Kemijska reakcija - jednadžba acetilen:
Acetilen u laboratoriju rezultat je sljedećih kemijskih reakcija:
1. djelovanje vode na kalcijev karbid:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. dehidrogenacija metana:
2CH4 → C2H2 + 3H2 (podložno > 1500 OC).
3. dehidrogenacija etilena:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Al2O3, do = 400-600 ° C).
Acetilen u industriji primati na sljedeće načine i metode:
4. karbidna metoda:
Prvo dobijte vapno iz kalcijevog karbonata.
CaCO3 → Visoka + CO2. (do = 900-1200 oC).
Zatim uzmite karbid kalcija, stapanje kalcijev oksid i koksa u električnoj peći na temperaturi od 2500-3000 ° C.
Visoko + 3C → CaC2 + ŠTO. (do = 2500-3000 THE).
Unaprijediti, obrađuje se kalcijev karbid s vodom kod poznate reakcije.
CaC2 + H2O → CA(Oh)2 + C2H2.
Rezultat je acetilen visoke čistoće 99.9 %.
5. visokotemperaturno pucanje metana:
Visokotemperaturno pucanje metana provodi se prema poznatoj reakcijskoj degidrirovaniji metana u elektrolučnoj peći pri temperaturi od 2000-3000 ° C i napon između elektroda 1000 V. izlaz acetilena je 50 %.
6. razni načini pirolize metana:
Vrsta visokotemperaturnog pucanja metana su regenerativna piroliza (Wulffov postupak), oksidativna piroliza (Sachs-postupak ili BASF postupak), homogena piroliza, piroliza u mediju niske temperature plazma.
Tako, tijekom regenerativne pirolize prvo je sagorio metan i zagrijao mlaznicu peći do 1350-1400 ° C. Zatim kroz zagrijanu mlaznicu da se prekine protok metana, čime nastaje acetilen.
Tijekom oksidativne pirolize metana miješa se s kisikom i sagorijeva. Rezultirajuća toplina služi za zagrijavanje ostatka metana 1600 ° C, koji digidrive u acetilenu. Prinos acetilena je 30-32 %.
Tijekom homogene pirolize metana i kisika izgara se peć na temperaturi od 2000 ° C. Zatim, prethodno zagrijana na 600 ° C, ostatak metana prolazi kroz peć, čime nastaje acetilen.
Tijekom pirolize u okruženju s niskim temperaturama plazma metan se zagrijava mlazom ioniziranog plina (argon ili vodik).
Primjena i uporaba acetilena:
- kao sirovina u kemijskoj industriji za proizvodnju octene kiseline, etil alkohol, otapala, plastika, sintetička gume, aromatski ugljikovodici,
- za plinsko zavarivanje i rezanje metala,
- za tehničku ugljik,
- kao izvor vrlo svijetle, bijelo svjetlo u Autonomnoj svjetiljke, gdje se dobiva reakcijom kalcijevog karbida i vode.
Eksplozivnost acetilena i sigurnost u rukovanju:
Acetilen ima eksplozivna svojstva.
Stoga, liječenje acetilenom zahtijeva strogo poštivanje sigurnosnih pravila.
Acetilen gori i eksplodira čak i u odsutnosti kisika i drugih oksidirajućih sredstava.
Smjese acetilena sa zrakom je eksplozivno u vrlo širokom rasponu koncentracija.
Mlaz acetilenapušten na otvoreno, može se zapaliti od najmanje iskre, uključujući pražnjenje statičkog elektriciteta iz prsta.
Vzryvaet acetilen ovisi o mnogim čimbenicima: pritisak, temperatura, čistoća acetilena, sadržaj vlage, prisutnost katalizatora i drugih tvari i drugi razlozi.
Temperatura paljenja acetilena pri normalnom - atmosferski tlak u rasponu 500-600 ° C. Kada se tlak značajno smanji temperatura paljenja acetilena. Tako, pod pritiskom od 2 kgf / cm2 (0.2 MPa, 1,935682 BANKOMAT.) temperatura paljenja acetilena jednaka je 630 ° C. I to pod pritiskom od 22 kgf / cm2 (2.2 MPa, 21,292502 BANKOMAT.) temperatura paljenja acetilena jednaka 350 ° C.
Prisutnost acetilena u česticama različitih tvari povećava površinski kontakt i tako smanjuje temperaturu paljenja pri atmosferskom tlaku. Na primjer, aktivni ugljen snižava temperaturu paljenja acetilena na 400 ° C, hidrat željezovog oksida (hrđa) - do 280-300 ° C, željezne strugotine - do 520 ° C, mesingane strugotine do 500-520 ° C, karbida kalcija, do 500 ° C, aluminijev oksid - do 490 ° C, bakrene strugotine - 460 ° C, željezov oksid - 280 ° C, bakar oksid do 250 ° C.
Eksplozivnost acetilena smanjuje se razrjeđivanjem acetilena s drugim plinovi, na primjer dušik, metan ili propan.
Pod određenim uvjetima acetilen reagira sa bakar, srebro i Merkur da nastanu eksplozivni spojevi. Stoga, u proizvodnji opreme za acetilen (npr., ventili, cilindri) nemojte koristiti legurekoji sadrže više od 70 % S.
Skladištenje i transport acetilena, pomoću posebnih čeličnih cilindara bijele boje (s crvenim natpisom “A”) ispunjena inertnim poroznim materijal (npr., ugljen). Tako acetilen se čuva i transportira u tim vrećicama u obliku otopine acetilena u acetonu pod tlakom od 1.5-2.5 MPa.
Bilješka: © Fotografija //www.pexels.com, //pixabay.com



