Acétylène, préparation, Propriétés, réactions chimiques

Acétylène, préparation, Propriétés, et réactions chimiques.
Acétylène, C2H2 - classe de matière organique, alcynes, hydrocarbures insaturés.
Acétylène, formule, gaz, Caractéristiques, caractéristiques
Propriétés physiques de l'acétylène
Propriétés chimiques de l'acétylène
Production d'acétylène dans l'industrie et les laboratoires
Réaction chimique - équation acétylène
L'application et l'utilisation de l'acétylène
Explosivité de l'acétylène et sécurité de manipulation
Acétylène, formule, gaz, Caractéristiques:
Acétylène (aussi - jene) - classe de matière organique, alcynes, insaturé hydrocarburecomposé de deux atomes de carbone et de deux atomes d'hydrogène.
Le produit chimique la formule de l'acétylène est C2H2. Formule développée de l'acétylène, CH≡CH. Isomers n'a pas.
La structure de la molécule d'acétylène:
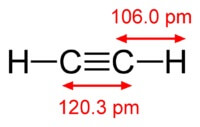
Acétylène a une triple liaison entre les atomes de carbone.
Acétylène - un gaz incolore, sans goût ni odeur. toutefois, l'acétylène technique contient des impuretés - phosphore hydrogène, sulfure d'hydrogène, etc., qui lui donnent une odeur piquante.
Plus facile air. Densité par rapport à la densité de l'air de 0.9.
Un très inflammable gaz. Inflammable et explosif.
Acétylène fait partie des rares composés, combustion et explosion qui est possible en l'absence d'oxygène ou d'autres agents oxydants.
Mélanges d'acétylène avec air est explosif dans une très large gamme de concentrations. Les risques d'explosion sont réduits lorsque l'acétylène dilué d'autres gaz, par exemple azote, méthane ou propane.
Acétylène nécessite beaucoup de soin lors de la manipulation. Peut exploser du choc, lorsqu'il est chauffé à 500 ° C ou compressé au-dessus 0.2 MPa à température ambiante. Un flux d'acétylène libéré à l'extérieur air, peut s'enflammer de la plus petite étincelle, y compris la décharge d'électricité statique du doigt. Stockage de l'acétylène à l'aide de cylindresrempli de matériau poreux imbibé d'acétone. L'acétylène est conservé en solution avec de l'acétone.
Légèrement soluble dans eau. Très soluble dans l'acétone. Soluble dans d'autres substances organiques (de l'essence, benzène, etc.)
Acétylène a un léger effet toxique.
Propriétés physiques de l'acétylène:
| Le nom du paramètre: | Valeur: |
| Couleur | sans couleur |
| L'odeur | inodore |
| Goût | pas de goût |
| État agrégé (à 20 ° C et pression atmosphérique de 1 AU M.) | gaz |
| Densité (à 20 ° C et pression atmosphérique de 1 AU M.) kg / m3 | 1,0896 |
| Densité (à 0 ° C et pression atmosphérique de 1 AU M.) kg / m3 | 1,173 |
| Point de fusion, ° C | -80,8 |
| Point d'ébullition, ° C | -80,55 |
| Point triple, ° C | 335 |
| La température d'auto-inflammation, ° C | 335 |
| La pression d'auto-allumage, MPa | 0,14-0,16 |
| Température critique*, ° C | De 35.94 |
| Pression critique, MPa | 6,26 |
| Concentration explosive du mélange de gaz avec l'air, % Par volume | 2.1 à 100 |
| Chaleur spécifique de combustion, MJ / kg | 56,9 |
| La température de la flamme, ° C | 3150-3200 |
| Masse molaire, g / mol | 26,038 |
* à des températures supérieures à la température critique le gaz ne peut être condensé à aucune pression.
Propriétés chimiques de l'acétylène:
Les propriétés chimiques de l'acétylène sont similaires aux propriétés d'autres représentants d'un certain nombre d'alcynes. Il est donc caractérisé par les réactions chimiques suivantes:
1. acétylène galogenirovannami:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrométhane);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tétrabromoéthane).
La réaction se déroule par étapes avec la formation de dérivés d'alcanes.
Au cours de cette réaction, acétylène décolore le brome eau.
2. hydrohalogénation acétylène:
CH≡CH + HBr → CH2 = CHBr (bromate).
3. hydratation de l'acétylène (réaction Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (énol) → CH3-CH = O (acétaldéhyde ) (kat = HgSO4, Hg(N ° 3)2).
4. trimérisation de l'acétylène (réaction Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzène) (kat = charbon actif, à = 450-500 LES).
La réaction de trimérisation de l'acétylène est un cas particulier de la réaction de polymérisation de l'acétylène se produit en passant de l'acétylène sur activé charbon à une température de 450-500 LES.
5. dimérisation de l'acétylène:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (obtenu du vinyl acétylène) (kat = solution aqueuse de CuCl et NH 4 CL).
La réaction de dimérisation de l'acétylène est un cas particulier de la réaction de polymérisation de l'acétylène.
6. la combustion d'acétylène:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
L'acétylène brûle avec une flamme blanche brillante.
7. l'oxydation de l'acétylène.
La réaction et ses produits sont déterminés par l'environnement dans lequel elle se produit.
8. récupération d'acétylène:
CH≡CH + H2 → C2H4 (éthylène) (kat = Ni, Pd ou Pt, augmenté à);
CH≡CH + 2H2 → C2H6 (éthane) (kat = Ni, Pd ou Pt, augmenté à).
Production d'acétylène dans l'industrie et en laboratoire. Réaction chimique - équation acétylène:
Acétylène dans le laboratoire est le résultat des réactions chimiques suivantes:
1. l'action de l'eau sur le carbure de calcium:
CaC2 + H2O → CA(Oh)2 + C2H2.
2. déshydrogénation du méthane:
2CH4 → C2H2 + 3H2 (sujet à > 1500 OC).
3. déshydrogénation de l'éthylène:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, à = 400-600 ° C).
Acétylène dans l'industrie recevoir des manières et méthodes suivantes:
4. méthode au carbure:
Obtenez d'abord la chaux du carbonate de calcium.
CaCO3 → Élevé + CO2. (à = 900-1200 oC).
Ensuite, prenez un carbure de calcium, fusion oxyde de calcium et du coke dans un four électrique à une température de 2500-3000 ° C.
CaO + 3C → CaC2 + CO. (à = 2500-3000 LES).
Plus loin, le carbure de calcium est traité avec de l'eau à une réaction connue.
CaC2 + H2O → CA(Oh)2 + C2H2.
Le résultat est un acétylène de haute pureté est 99.9 %.
5. craquage à haute température du méthane:
Le craquage à haute température du méthane est effectué selon la réaction degidrirovaniya connue du méthane dans un four à arc électrique à une température de 2000-3000 ° C et une tension entre les électrodes de 1000 V. la sortie d'acétylène est 50 %.
6. les différents modes de pyrolyse du méthane:
Un type de craquage à haute température du méthane est la pyrolyse régénérative (Processus Wulff), pyrolyse oxydante (Processus Sachs ou processus BASF), pyrolyse homogène, pyrolyse au milieu de basse température plasma.
Donc, pendant la pyrolyse régénérative, brûler d'abord du méthane et chauffer la buse du four à 1350-1400 ° C. Puis à travers une buse chauffée pour couper l'écoulement du méthane, formant ainsi de l'acétylène.
Au cours de la pyrolyse oxydative du méthane est mélangé avec de l'oxygène et brûlé. La chaleur qui en résulte sert à chauffer le reste du méthane à 1600 ° C, qui digidrive dans l'acétylène. Le rendement en acétylène est 30-32 %.
Pendant la pyrolyse homogène du méthane et de l'oxygène est brûlé dans un four à une température de 2000 ° C. Puis, préchauffé à 600 ° C, le reste du méthane passe à travers le four, formant ainsi de l'acétylène.
Lors de la pyrolyse dans un environnement à basse température plasma le méthane est chauffé par un jet de gaz ionisé (argon ou hydrogène).
L'application et l'utilisation de l'acétylène:
- comme matière première dans l'industrie chimique pour la production d'acide acétique, alcool éthylique, solvants, les plastiques, synthétique caoutchoucs, Hydrocarbures aromatiques,
- pour le soudage au gaz et la coupe des métaux,
- pour technique carbone,
- comme source de très lumineux, lumière blanche dans les Autonomes les lampes, où il est obtenu par réaction de carbure de calcium et d'eau.
Explosivité de l'acétylène et sécurité de manipulation:
Acétylène a des propriétés explosives.
Donc, traitement à l'acétylène nécessite un strict respect des règles de sécurité.
Acétylène brûle et explose même en l'absence d'oxygène et d'autres agents oxydants.
Les mélanges d'acétylène avec l'air sont explosif dans une très large gamme de concentrations.
Un jet d'acétylènelibéré à l'air libre, peut s'enflammer de la plus petite étincelle, y compris la décharge d'électricité statique du doigt.
Acétylène Vzryvaet dépend de nombreux facteurs: pression, Température, pureté de l'acétylène, la teneur en humidité, la présence de catalyseurs et d'autres substances et d'autres raisons.
La température d'inflammation de l'acétylène à la normale - pression atmosphérique dans la plage 500-600 ° C. Lorsque la pression diminue considérablement la température d'inflammation de l'acétylène. Donc, à une pression de 2 kgf / cm2 (0.2 MPa, 1,935682 AU M.) la température d'inflammation de l'acétylène est égale à 630 ° C. Et à une pression de 22 kgf / cm2 (2.2 MPa, 21,292502 AU M.) la température d'inflammation de l'acétylène égale à 350 ° C.
La présence d'acétylène de particules de différentes substances augmente le contact de surface et réduit ainsi la température d'inflammation à pression atmosphérique. Par exemple, le charbon actif abaisse la température d'inflammation de l'acétylène à 400 ° C, l'hydrate d'oxyde de fer (rouille) - Jusqu'à 280-300 ° C, copeaux de fer - jusqu'à 520 ° C, copeaux de laiton jusqu'à 500-520 ° C, carbure de calcium, Jusqu'à 500 ° C, oxyde d'aluminium - jusqu'à 490 ° C, copeaux de cuivre - 460 ° C, l'oxyde de fer - 280 ° C, oxyde de cuivre jusqu'à 250 ° C.
Explosivité de l'acétylène diminue avec la dilution de l'acétylène avec d'autres des gaz, par exemple l'azote, méthane ou propane.
Dans certaines conditions, l'acétylène réagit avec cuivre, argent et Mercure pour former des composés explosifs. Donc, dans la fabrication d'équipements d'acétylène (par exemple., vannes, cylindres) ne pas utiliser alliagescontenant plus de 70 % Cu.
Stockage et transport d'acétylène, utilisant des cylindres en acier spécial de couleur blanche (avec une inscription rouge “UNE”) rempli d'un poreux inerte Matériel (par exemple., charbon). Donc l'acétylène est stocké et transporté dans ces sacs sous forme d'une solution d'acétylène dans l'acétone sous pression de 1.5-2.5 MPa.
Remarque: © Photo //www.pexels.com, //pixabay.com