Ασετυλίνη, παρασκευή, ιδιότητες, χημικές αντιδράσεις

Ασετυλίνη, παρασκευή, ιδιότητες, και χημικές αντιδράσεις.
Ασετυλίνη, C2H2 - κλάση οργανικής ύλης, αλκύνια, ακόρεστοι υδρογονάνθρακες.
Ασετυλίνη, τύπος, αέριο, Προδιαγραφές, Χαρακτηριστικά
Φυσικές ιδιότητες του ακετυλενίου
Χημικές ιδιότητες του ακετυλενίου
Παραγωγή ακετυλενίου στη βιομηχανία και τα εργαστήρια
Χημική αντίδραση - εξίσωση ακετυλενίου
Η εφαρμογή και η χρήση του ακετυλενίου
Εκρηκτικό ακετυλένιο και ασφάλεια κατά το χειρισμό
Ασετυλίνη, τύπος, αέριο, χαρακτηριστικά:
Ασετυλίνη (επίσης - jene) - κλάση οργανικής ύλης, αλκύνια, ακόρεστα υδρογονάνθραξπου αποτελείται από δύο άτομα άνθρακα και δύο άτομα υδρογόνου.
Η χημική ουσία ο τύπος του ακετυλενίου είναι C2H2. Δομικός τύπος ακετυλενίου, CH≡CH. Το Isomers δεν έχει.
Η δομή του μορίου του ακετυλενίου:
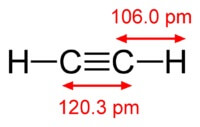
Ασετυλίνη έχει τριπλό δεσμό μεταξύ ατόμων άνθρακα.
Ασετυλίνη - ένα άχρωμο αέριο, χωρίς γεύση και μυρωδιά. Ωστόσο, το τεχνικό ακετυλένιο περιέχει ακαθαρσίες - φωσφόρο υδρογόνο, υδρόθειο, και τα λοιπά., που του δίνουν μια έντονη μυρωδιά.
Ευκολότερη αέρας. Πυκνότητα σε σύγκριση με την πυκνότητα του αέρα του 0.9.
Πολύ εύφλεκτο αέριο. Εύφλεκτο και εκρηκτικό.
Ασετυλίνη είναι από τις λίγες ενώσεις, καύση και έκρηξη που είναι δυνατή απουσία οξυγόνου ή άλλους οξειδωτικούς παράγοντες.
Μείγματα ακετυλενίου με αέρας είναι εκρηκτικό σε πολύ μεγάλο εύρος συγκεντρώσεων. Οι κίνδυνοι έκρηξης μειώνονται όταν αραιώνεται το ακετυλένιο άλλων αερίων, για παράδειγμα άζωτο, μεθάνιο ή προπάνιο.
Ασετυλίνη απαιτεί μεγάλη προσοχή στο χειρισμό. Μπορεί να εκραγεί από σοκ, όταν θερμαίνεται 500 ° C ή όταν συμπιέζεται παραπάνω 0.2 MPa σε θερμοκρασία δωματίου. Ένα ρεύμα ακετυλενίου απελευθερώνεται σε εξωτερικό χώρο αέρας, μπορεί να αναφλεγεί από τη μικρότερη σπίθα, συμπεριλαμβανομένης της στατικής ηλεκτρικής εκφόρτισης από το δάχτυλο. Αποθήκευση ακετυλενίου με ειδικό κύλινδροιγεμισμένο με πορώδες υλικό εμποτισμένο με ακετόνη. Το ακετυλένιο αποθηκεύεται σε διάλυμα με ακετόνη.
Ελαφρώς διαλυτό νερό. Πολύ διαλυτό σε ακετόνη. Διαλυτό σε άλλες οργανικές ουσίες (βενζίνη, βενζόλιο, και τα λοιπά.)
Ασετυλίνη έχει ελαφριά τοξική δράση.
Φυσικές ιδιότητες του ακετυλενίου:
| Όνομα παραμέτρου: | αξία: |
| Χρώμα | χωρίς χρώμα |
| Η μυρωδιά | άοσμος |
| Γεύση | χωρίς γεύση |
| Συνολική κατάσταση (στο 20 ° C και ατμοσφαιρική πίεση 1 ΑΤΜ.) | αέριο |
| Πυκνότητα (στο 20 ° C και ατμοσφαιρική πίεση 1 ΑΤΜ.) kg / m3 | 1,0896 |
| Πυκνότητα (στο 0 ° C και ατμοσφαιρική πίεση 1 ΑΤΜ.) kg / m3 | 1,173 |
| Σημείο τήξης, ° C | -80,8 |
| Σημείο βρασμού, ° C | -80,55 |
| Τριπλό σημείο, ° C | 335 |
| Η θερμοκρασία αυτόματης ανάφλεξης, ° C | 335 |
| Η πίεση αυτόματης ανάφλεξης, MPa | 0,14-0,16 |
| Κρίσιμη θερμοκρασία*, ° C | Του 35.94 |
| Κρίσιμη πίεση, MPa | 6,26 |
| Εκρηκτική συγκέντρωση του μείγματος αερίου με αέρα, % κατ 'όγκο | 2.1 προς την 100 |
| Ειδική θερμότητα καύσης, MJ / kg | 56,9 |
| Θερμοκρασία φλόγας, ° C | 3150-3200 |
| Μοριακή μάζα, g / mol | 26,038 |
* σε θερμοκρασίες πάνω από την κρίσιμη θερμοκρασία το αέριο δεν μπορεί να συμπυκνωθεί σε οποιαδήποτε πίεση.
Χημικές ιδιότητες του ακετυλενίου:
Οι χημικές ιδιότητες του ακετυλενίου είναι παρόμοιες με τις ιδιότητες άλλων αντιπροσώπων ενός αριθμού αλκυνών. Έτσι χαρακτηρίζεται από τις ακόλουθες χημικές αντιδράσεις:
1. ακετυλένιο galogenirovannami:
CH≡CH + Br2 → CHBr = CHBr (1,2-διβρομεθάνιο);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-τετραβρωμοαιθάνιο).
Η αντίδραση προχωρά σταδιακά με το σχηματισμό παραγώγων αλκανίων.
Κατά τη διάρκεια αυτής της αντίδρασης, ακετυλένιο αποχρωματίζει το βρώμιο νερό.
2. ακετυλένιο υδροαλογόνωσης:
CH≡CH + HBr → CH2 = CHBr (βρωμικό αλάτι).
3. ενυδάτωση ακετυλενίου (αντίδραση Michael G. Κουτσέροφ, 1881):
CH≡CH + H2O → [CH2 = CH-ΟΗ] (ενολ) → CH3-CH = O (οξική αλδείνη ) (kat = HgSO4, Hg(ΝΟ3)2).
4. τριμερισμός του ακετυλενίου (αντίδραση Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (βενζόλιο) (kat = ενεργός άνθρακας, έως = 450-500 Ο).
Η αντίδραση του τριμερισμού του ακετυλενίου είναι μια ειδική περίπτωση της αντίδρασης πολυμερισμού ακετυλενίου συμβαίνει περνώντας ακετυλένιο πάνω από ενεργοποιημένο ξυλάνθρακας σε θερμοκρασία 450-500 Ο.
5. διμερισμός του ακετυλενίου:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (έλαβε βινυλο ακετυλένιο) (kat = υδατικό διάλυμα CuCl και NH 4 CL).
Η αντίδραση διμερισμού του ακετυλενίου είναι μια ειδική περίπτωση της αντίδρασης πολυμερισμού ακετυλενίου.
6. την καύση του ακετυλενίου:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Το ακετυλένιο καίγεται με μια λευκή φωτεινή φλόγα.
7. την οξείδωση του ακετυλενίου.
Η αντίδραση και τα προϊόντα της καθορίζονται από το περιβάλλον στο οποίο συμβαίνει.
8. ανάκτηση ακετυλενίου:
CH≡CH + H2 → C2H4 (αιθυλένιο) (kat = Νι, Pd ή Pt, αυξήθηκε σε);
CH≡CH + 2H2 → C2H6 (αιθάνιο) (kat = Νι, Pd ή Pt, αυξήθηκε σε).
Παραγωγή ακετυλενίου στη βιομηχανία και στο εργαστήριο. Χημική αντίδραση - εξίσωση ακετυλενίου:
Ασετυλίνη στο εργαστήριο είναι το αποτέλεσμα των ακόλουθων χημικών αντιδράσεων:
1. τη δράση του νερού στο καρβίδιο του ασβεστίου:
CaC2 + H2O → CA(Ω)2 + C2H2.
2. αφυδρογόνωση μεθανίου:
2CH4 → C2H2 + 3Η2 (όποιος υπακούει σε κάτι > 1500 ΟΚ).
3. αφυδρογόνωση αιθυλενίου:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Νι, Al2O3, Cr2O3, έως = 400-600 ° C).
Ασετυλίνη στη βιομηχανία λάβετε με τους ακόλουθους τρόπους και μεθόδους:
4. μέθοδος καρβιδίου:
Αρχικά πάρτε ασβέστη από ανθρακικό ασβέστιο.
CaCO3 → Υψηλή + CO2. (έως = 900-1200 oC).
Τότε πάρτε ένα καρβίδιο ασβεστίου, σύντηξη οξείδιο του ασβεστίου και οπτάνθρακα σε ηλεκτρικό κλίβανο σε θερμοκρασία 2500-3000 ° C.
Υψηλός + 3C → CaC2 + CO. (έως = 2500-3000 Ο).
Περαιτέρω, επεξεργάζεται το καρβίδιο του ασβεστίου με νερό σε μια γνωστή αντίδραση.
CaC2 + H2O → CA(Ω)2 + C2H2.
Το αποτέλεσμα είναι ένα ακετυλένιο υψηλής καθαρότητας είναι 99.9 %.
5. υψηλής θερμοκρασίας ρωγμή μεθανίου:
Υψηλής θερμοκρασίας ρωγμή μεθανίου πραγματοποιείται σύμφωνα με γνωστή αντίδραση degidrirovaniya του μεθανίου σε ηλεκτρικό κλίβανο τόξου σε θερμοκρασία 2000-3000 ° C και τάση μεταξύ των ηλεκτροδίων του 1000 Β. η έξοδος του ακετυλενίου είναι 50 %.
6. οι διάφοροι τρόποι πυρόλυσης του μεθανίου:
Ένας τύπος πυρόλυσης μεθανίου υψηλής θερμοκρασίας είναι η αναγεννητική πυρόλυση (Διαδικασία Wulff), οξειδωτική πυρόλυση (Διαδικασία Sachs ή διαδικασία BASF), ομοιογενής πυρόλυση, πυρόλυση στο μέσο χαμηλής θερμοκρασίας πλάσμα αίματος.
Ετσι, κατά τη διάρκεια της αναγεννητικής πυρόλυσης πρώτα έκαψε μεθάνιο και θερμάνθηκε το ακροφύσιο του φούρνου προς την 1350-1400 ° C. Στη συνέχεια, μέσα από ένα θερμαινόμενο ακροφύσιο για να διακόψει τη ροή του μεθανίου, σχηματίζοντας έτσι ακετυλένιο.
Κατά τη διάρκεια της οξειδωτικής πυρόλυσης του μεθανίου αναμιγνύεται με οξυγόνο και καίγεται. Η προκύπτουσα θερμότητα χρησιμεύει για τη θέρμανση του υπολοίπου του μεθανίου 1600 ° C, που digidrive σε ακετυλένιο. Η απόδοση του ακετυλενίου είναι 30-32 %.
Κατά τη διάρκεια της ομογενούς πυρόλυσης μεθανίου και οξυγόνου καίγεται φούρνο σε θερμοκρασία 2000 ° C. Επειτα, προθερμασμένο σε 600 ° C, το υπόλοιπο του μεθανίου περνά μέσα από τον κλίβανο, σχηματίζοντας έτσι ακετυλένιο.
Κατά τη διάρκεια της πυρόλυσης σε περιβάλλον χαμηλής θερμοκρασίας πλάσμα αίματος το μεθάνιο θερμαίνεται με εκτόξευση ιονισμένου αερίου (αργόν ή υδρογόνο).
Η εφαρμογή και η χρήση του ακετυλενίου:
- ως πρώτη ύλη στη χημική βιομηχανία για την παραγωγή οξικού οξέος, εθυλική αλκοόλη, διαλύτες, πλαστικά είδη, συνθετικός γαλότσες, αρωματικοί υδρογονάνθρακες,
- για συγκόλληση και κοπή μετάλλων αερίου,
- για τεχνικό άνθρακας,
- ως πηγή πολύ φωτεινών, λευκό φως στο αυτόνομο λαμπτήρες, όπου λαμβάνεται με την αντίδραση του καρβιδίου του ασβεστίου και του νερού.
Εκρηκτικό ακετυλένιο και ασφάλεια κατά το χειρισμό:
Ασετυλίνη έχει εκρηκτικές ιδιότητες.
Επομένως, επεξεργασία με ακετυλένιο απαιτεί αυστηρή τήρηση των κανόνων ασφαλείας.
Ασετυλίνη καίει και εκρήγνυται ακόμη και απουσία οξυγόνου και άλλων οξειδωτικών μέσων.
Μείγματα ακετυλενίου με αέρα είναι εκρηκτικό σε πολύ μεγάλο εύρος συγκεντρώσεων.
Ένα πίδακα ακετυλενίουαπελευθερώθηκε στον αέρα, μπορεί να αναφλεγεί από τη μικρότερη σπίθα, συμπεριλαμβανομένης της στατικής ηλεκτρικής εκφόρτισης από το δάχτυλο.
Vzryvaet ακετυλένιο εξαρτάται από πολλούς παράγοντες: πίεση, θερμοκρασία, καθαρότητα ακετυλενίου, το περιεχόμενο της υγρασίας, την παρουσία καταλυτών και άλλων ουσιών και άλλους λόγους.
Η θερμοκρασία ανάφλεξης του ακετυλενίου σε κανονική - ατμοσφαιρική πίεση στο εύρος 500-600 ° C. Όταν η πίεση μειώνει σημαντικά τη θερμοκρασία ανάφλεξης του ακετυλενίου. Ετσι, σε πίεση 2 kgf / cm2 (0.2 MPa, 1,935682 ΑΤΜ.) η θερμοκρασία ανάφλεξης του ακετυλενίου είναι ίση με 630 ° C. Και σε πίεση 22 kgf / cm2 (2.2 MPa, 21,292502 ΑΤΜ.) η θερμοκρασία ανάφλεξης του ακετυλενίου είναι ίση με 350 ° C.
Η παρουσία ακετυλενίου σωματιδίων διαφορετικών ουσιών αυξάνει την επιφάνεια επαφής και μειώνει έτσι τη θερμοκρασία ανάφλεξης σε ατμοσφαιρική πίεση. Για παράδειγμα, Ο ενεργός άνθρακας μειώνει τη θερμοκρασία ανάφλεξης του ακετυλενίου 400 ° C, το ένυδρο οξείδιο του σιδήρου (σκουριά) - μέχρι και 280-300 ° C, ξέσματα σιδήρου - έως 520 ° C, ροκανίδια ορείχαλκου έως 500-520 ° C, καρβίδιο του ασβεστίου, μέχρι και 500 ° C, οξείδιο αργιλίου - έως 490 ° C, ξέσματα χαλκού - 460 ° C, το οξείδιο του σιδήρου - 280 ° C, οξείδιο του χαλκού έως 250 ° C.
Εκρηκτικό ακετυλένιο μειώνεται με αραίωση ακετυλενίου με άλλα αέρια, για παράδειγμα άζωτο, μεθάνιο ή προπάνιο.
Υπό ορισμένες συνθήκες το ακετυλένιο αντιδρά με χαλκός, ασήμι και Ερμής να σχηματίσουν εκρηκτικές ενώσεις. Επομένως, στην κατασκευή εξοπλισμού ακετυλενίου (π.χ., βαλβίδες, κύλινδροι) μη χρησιμοποιεις κράματαπου περιέχει περισσότερα από 70 % Με.
Αποθήκευση και μεταφορά ακετυλενίου, χρησιμοποιώντας ειδικούς χαλύβδινους κυλίνδρους λευκό χρώμα (με κόκκινη επιγραφή “ΕΝΑ”) γεμάτο με ένα αδρανές πορώδες υλικό (π.χ., ξυλάνθρακας). Ετσι Το ακετυλένιο αποθηκεύεται και μεταφέρεται σε αυτούς τους σάκους με τη μορφή διαλύματος ακετυλενίου σε ακετόνη υπό πίεση 1.5-2.5 MPa.
Σημείωση: © Φωτογραφία //www.pexels.com, //pixabay.com



