Acetylen, Vorbereitung, Eigenschaften, chemische Reaktionen

Acetylen, Vorbereitung, Eigenschaften, und chemische Reaktionen.
Acetylen, C2H2 - Klasse organischer Stoffe, Alkine, ungesättigte Kohlenwasserstoffe.
Acetylen, Formel, Gas, Spezifikationen, Eigenschaften
Physikalische Eigenschaften von Acetylen
Chemische Eigenschaften von Acetylen
Herstellung von Acetylen in Industrie und Labor
Chemische Reaktion - Gleichung Acetylen
Die Anwendung und Verwendung von Acetylen
Explosivität von Acetylen und Sicherheit bei der Handhabung
Acetylen, Formel, Gas, Eigenschaften:
Acetylen (auch - jene) - Klasse der organischen Materie, Alkine, ungesättigt Kohlenwasserstoffbestehend aus zwei Kohlenstoffatomen und zwei Wasserstoffatomen.
Die Chemikalie Formel von Acetylen ist C2H2. Strukturformel von Acetylen, CH≡CH. Isomere hat nicht.
Die Struktur des Acetylenmoleküls:
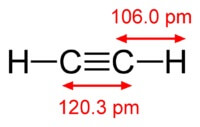
Acetylen hat eine Dreifachbindung zwischen Atomen von Kohlenstoff.
Acetylen - ein farbloses Gas, ohne Geschmack und Geruch. jedoch, Das technische Acetylen enthält Verunreinigungen - Phosphor Wasserstoff, Schwefelwasserstoff, etc., die es einen stechenden Geruch geben.
Einfacher Luft. Dichte im Vergleich zur Dichte der Luft von 0.9.
Eine sehr brennbare Gas. Entzündlich und explosiv.
Acetylen gehört zu den wenigen Verbindungen, Verbrennung und Explosion, die in Abwesenheit möglich sind von Sauerstoff oder andere Oxidationsmittel.
Gemische von Acetylen mit Luft ist in einem sehr weiten Konzentrationsbereich explosiv. Explosionsgefahren werden reduziert, wenn Acetylen andere Gase verdünnt, beispielsweise Stickstoff-, Methan oder Propan.
Acetylen erfordert große Sorgfalt bei der Handhabung. Kann vor Schock explodieren, beim Erhitzen auf 500 ° C oder wenn oben komprimiert 0.2 MPa bei Raumtemperatur. Ein Strom von Acetylen wird ins Freie freigesetzt Luft, kann sich vom kleinsten Funken entzünden, einschließlich statischer Elektrizität Entladung vom Finger. Lagerung von Acetylen mit Spezial Zylindergefüllt mit porösem Material, das mit Aceton getränkt ist. Das Acetylen wird in Lösung mit Aceton gelagert.
Leicht löslich in Wasser. Sehr gut löslich in Aceton. Löslich in anderen organischen Substanzen (Benzin, Benzol, etc.)
Acetylen hat eine leichte toxische Wirkung.
Physikalische Eigenschaften von Acetylen:
| Parametername: | Wert: |
| Farbe | ohne Farbe |
| Der Geruch | geruchlos |
| Geschmack | kein Geschmack |
| Gesamtzustand (beim 20 ° C und atmosphärischer Druck von 1 GELDAUTOMAT.) | Gas |
| Dichte (beim 20 ° C und atmosphärischer Druck von 1 GELDAUTOMAT.) kg / m3 | 1,0896 |
| Dichte (beim 0 ° C und atmosphärischer Druck von 1 GELDAUTOMAT.) kg / m3 | 1,173 |
| Schmelzpunkt, ° C. | -80,8 |
| Siedepunkt, ° C. | -80,55 |
| Dreifacher Punkt, ° C. | 335 |
| Die Selbstentzündungstemperatur, ° C. | 335 |
| Der Selbstentzündungsdruck, MPa | 0,14-0,16 |
| Kritische Temperatur*, ° C. | Von 35.94 |
| Kritischer Druck, MPa | 6,26 |
| Explosive Konzentration des Gasgemisches mit Luft, % nach Ausgabe | 2.1 zu 100 |
| Spezifische Verbrennungswärme, MJ / kg | 56,9 |
| Flammentemperatur, ° C. | 3150-3200 |
| Molmasse, g / mol | 26,038 |
* bei Temperaturen über der kritischen Temperatur das Gas kann bei keinem Druck kondensiert werden.
Chemische Eigenschaften von Acetylen:
Die chemischen Eigenschaften von Acetylen ähneln den Eigenschaften anderer Vertreter einer Reihe von Alkinen. Es zeichnet sich also durch folgende chemische Reaktionen aus:
1. Galogenirovannami-Acetylen:
CH≡CH + Br2 → CHBr = CHBr (1,2-Dibromethan);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-Tetrabromethan).
Die Reaktion verläuft stufenweise unter Bildung von Derivaten von Alkanen.
Während dieser Reaktion, Acetylen verfärbt Brom Wasser.
2. Hydrohalogenierungsacetylen:
CH≡CH + HBr → CH2 = CHBr (Bromat).
3. Hydratisierung von Acetylen (Reaktion Michael G.. Kucherov, 1881):
CH≡CH + H2O → [CH 2 = CH-OH] (Enol) → CH3-CH = O. (Acetaldehyd ) (kat = HgSO4, Hg(NR. 3)2).
4. Trimerisierung von Acetylen (Reaktion Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (Benzol) (kat = Aktivkohle, zu = 450-500 DAS).
Die Reaktion der Trimerisierung von Acetylen ist ein Sonderfall der Reaktion der Polymerisation von Acetylen tritt auf, indem Acetylen über aktiviert geleitet wird Holzkohle bei einer Temperatur von 450-500 DAS.
5. Dimerisierung von Acetylen:
CH≡CH + CH≡CH → CH2 = CH-C≡CH (erhaltenes Vinylacetylen) (kat = wässrige Lösung von CuCl und NH 4 CL).
Die Reaktion der Dimerisierung von Acetylen ist ein Sonderfall der Reaktion der Polymerisation von Acetylen.
6. die Verbrennung von Acetylen:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Acetylen brennt mit einer weißen hellen Flamme.
7. die Oxidation von Acetylen.
Die Reaktion und ihre Produkte werden durch die Umgebung bestimmt, in der sie auftritt.
8. Rückgewinnung von Acetylen:
CH≡CH + H2 → C2H4 (Ethylen) (kat = Ni, Pd oder Pt, stieg auf);
CH≡CH + 2H2 → C2H6 (Ethan) (kat = Ni, Pd oder Pt, stieg auf).
Herstellung von Acetylen in der Industrie und im Labor. Chemische Reaktion - Gleichung Acetylen:
Acetylen im Labor ist das Ergebnis der folgenden chemischen Reaktionen:
1. die Wirkung von Wasser auf Calciumcarbid:
CaC2 + H2O → CA.(Oh)2 + C2H2.
2. Dehydrierung von Methan:
2CH4 → C2H2 + 3H2 (vorbehaltlich > 1500 OK).
3. Dehydrierung von Ethylen:
CH2 = CH2 → CH≡CH + H2 (kat = Pt, Im, Al2O3, Cr2O3, zu = 400-600 ° C.).
Acetylen in der Industrie auf folgende Weise und Methoden erhalten:
4. Hartmetallmethode:
Holen Sie sich zuerst Kalk aus Kalziumkarbonat.
CaCO3 → Hoch + CO2. (zu = 900-1200 oC).
Dann hol ein Hartmetall von Kalzium, Verschmelzen Calciumoxid und Koks in einem Elektroofen bei einer Temperatur von 2500-3000 ° C..
Hoch + 3C → CaC2 + CO. (zu = 2500-3000 DAS).
Des Weiteren, Calciumcarbid wird behandelt mit Wasser bei einer bekannten Reaktion.
CaC2 + H2O → CA.(Oh)2 + C2H2.
Das Ergebnis ist ein hochreines Acetylen 99.9 %.
5. Hochtemperaturcracken von Methan:
Das Hochtemperaturcracken von Methan wird gemäß der bekannten Reaktion degidrirovaniya von Methan in einem Lichtbogenofen bei einer Temperatur von durchgeführt 2000-3000 ° C und eine Spannung zwischen den Elektroden von 1000 V.. die Ausgabe von Acetylen ist 50 %.
6. die verschiedenen Arten der Pyrolyse von Methan:
Eine Art des Hochtemperaturcrackens von Methan ist die regenerative Pyrolyse (Wulff-Prozess), oxidative Pyrolyse (Sachs-Prozess oder BASF-Prozess), homogene Pyrolyse, Pyrolyse im Medium niedriger Temperatur Plasma.
So, Während der regenerativen Pyrolyse wird zuerst Methan verbrannt und die Düse erwärmt des Ofens zu 1350-1400 ° C.. Dann durch eine beheizte Düse, um den Methanfluss zu unterbrechen, wodurch Acetylen gebildet wird.
Im Verlauf der oxidativen Pyrolyse wird Methan mit Sauerstoff gemischt und verbrannt. Die entstehende Wärme dient dazu, den Rest des Methans zu erwärmen 1600 ° C., welche Digidrive in Acetylen. Die Ausbeute an Acetylen beträgt 30-32 %.
Während der homogenen Pyrolyse von Methan und Sauerstoff wird eingebrannt ein Ofen bei einer Temperatur von 2000 ° C.. Dann, vorgewärmt auf 600 ° C., Der Rest des Methans wird durch den Ofen geleitet, wodurch Acetylen gebildet wird.
Während der Pyrolyse in einer Umgebung mit niedriger Temperatur Plasma Methan wird durch einen ionisierten Gasstrahl erhitzt (Argon oder Wasserstoff).
Die Anwendung und Verwendung von Acetylen:
- als Rohstoff in der chemischen Industrie zur Herstellung von Essigsäure, Ethylalkohol, Lösungsmittel, Kunststoffe, Synthetik Gummi, aromatische Kohlenwasserstoffe,
- zum Gasschweißen und Schneiden von Metallen,
- für technische Kohlenstoff,
- als Quelle von sehr hell, weißes Licht im Autonomen Lampen, wo es durch die Reaktion von Calciumcarbid und Wasser erhalten wird.
Explosivität von Acetylen und Sicherheit bei der Handhabung:
Acetylen hat explosive Eigenschaften.
Deshalb, Behandlung mit Acetylen erfordert die strikte Einhaltung der Sicherheitsregeln.
Acetylen brennt und explodiert auch in Abwesenheit von Sauerstoff und anderen Oxidationsmitteln.
Gemische von Acetylen mit Luft sind explosiv in einem sehr breiten Konzentrationsbereich.
Ein Acetylenstrahlins Freie entlassen, kann sich vom kleinsten Funken entzünden, einschließlich statischer Elektrizität Entladung vom Finger.
Vzryvaet Acetylen hängt von vielen Faktoren ab: Druck, Temperatur, Reinheit von Acetylen, der Gehalt an Feuchtigkeit, das Vorhandensein von Katalysatoren und anderen Substanzen und andere Gründe.
Die Zündtemperatur von Acetylen bei normalem - atmosphärischem Druck im Bereich 500-600 ° C.. Wenn der Druck die Zündtemperatur von Acetylen signifikant verringert. So, bei einem Druck von 2 kgf / cm² (0.2 MPa, 1,935682 GELDAUTOMAT.) Die Zündtemperatur von Acetylen ist gleich 630 ° C.. Und unter einem Druck von 22 kgf / cm² (2.2 MPa, 21,292502 GELDAUTOMAT.) die Zündtemperatur von Acetylen ist gleich 350 ° C..
Das Vorhandensein von Acetylen von Partikeln verschiedener Substanzen erhöht den Oberflächenkontakt und verringert somit die Zündtemperatur bei atmosphärischem Druck. Beispielsweise, Aktivkohle senkt die Zündtemperatur von Acetylen auf 400 ° C., das Hydrat von Eisenoxid (Rost) - bis zu 280-300 ° C., Eisenspäne - bis zu 520 ° C., Messingspäne bis zu 500-520 ° C., Kalziumkarbid, bis zu 500 ° C., Aluminiumoxid - bis zu 490 ° C., Kupferspäne - 460 ° C., das Eisenoxid - 280 ° C., Kupferoxid bis zu 250 ° C..
Explosivität von Acetylen nimmt mit der Verdünnung von Acetylen mit anderen ab Gase, zum Beispiel Stickstoff, Methan oder Propan.
Unter bestimmten Bedingungen reagiert Acetylen mit Kupfer, Silber- und Merkur explosive Verbindungen zu bilden. Deshalb, bei der Herstellung von Acetylen-Geräten (z.B., Ventile, Zylinder) verwende nicht Legierungenmit mehr als 70 % Cu.
Lagerung und Transport von Acetylen, mit speziellen Stahlzylindern weiße Farbe (mit einer roten Inschrift “EIN”) gefüllt mit einem inerten porösen Material (z.B., Holzkohle). So Acetylen wird gelagert und transportiert in diesen Beuteln in Form einer Lösung von Acetylen in Aceton unter Druck von 1.5-2.5 MPa.
Hinweis: © Foto //www.pexels.com, //pixabay.com



