Acetylen, forberedelse, ejendomme, kemiske reaktioner

Acetylen, forberedelse, ejendomme, og kemiske reaktioner.
Acetylen, C2H2 - organisk stofklasse, alkyner, umættede kulbrinter.
Acetylen, formel, gas, specifikationer, egenskaber
Fysiske egenskaber af acetylen
Kemiske egenskaber af acetylen
Produktion af acetylen i industrien og laboratorier
Kemisk reaktion - ligning acetylen
Anvendelse og anvendelse af acetylen
Eksplosivitet af acetylen og sikkerhed ved håndtering
Acetylen, formel, gas, funktioner:
Acetylen (også - jene) - klasse med organisk materiale, alkyner, umættet carbonhydridbestående af to carbonatomer og to hydrogenatomer.
Kemikaliet formlen af acetylen er C2H2. Strukturformel af acetylen, CH≡CH. Isomers har ikke.
Strukturen af acetylenmolekyle:
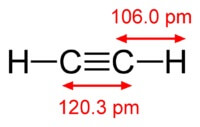
Acetylen har en tredobbelt binding mellem atomer af kulstof.
Acetylen - en farveløs gas, uden smag og lugt. Imidlertid, den tekniske acetylen indeholder urenheder - fosfor hydrogen, svovlbrinte, etc., som giver det en skarp lugt.
Lettere luft. Densitet sammenlignet med densiteten af luften af 0.9.
En meget brandfarlig gas. Brandfarlig og eksplosiv.
Acetylen er blandt de få forbindelser, forbrænding og eksplosion, som er mulig i fravær af ilt eller andre oxidationsmidler.
Blandinger af acetylen med luft er eksplosiv i en meget bred vifte af koncentrationer. Eksplosionsfarerne reduceres ved fortyndet acetylen andre gasser, for eksempel kvælstof, metan eller propan.
Acetylen kræver stor omhu ved håndtering. Kan eksplodere af chok, når den opvarmes til 500 ° C eller når komprimeret ovenfor 0.2 MPa ved stuetemperatur. En strøm af acetylen frigivet til udendørs luft, kan antænde fra den mindste gnist, inklusive afladning af statisk elektricitet fra fingeren. Opbevaring af acetylen ved hjælp af special cylindrefyldt med porøst materiale gennemblødt med acetone. De acetylen opbevares i opløsning med acetone.
Let opløselig i vand. Meget opløselig i acetone. Opløselig i andre organiske stoffer (benzin, benzen, etc.)
Acetylen har en let toksisk virkning.
Fysiske egenskaber af acetylen:
| Parameternavn: | Værdi: |
| Farve | uden farve |
| Lugten | lugtfri |
| Smag | ingen smag |
| Samlet tilstand (på 20 ° C og atmosfærisk tryk på 1 Hæveautomat.) | gas |
| Massefylde (på 20 ° C og atmosfærisk tryk på 1 Hæveautomat.) kg / m3 | 1,0896 |
| Massefylde (på 0 ° C og atmosfærisk tryk på 1 Hæveautomat.) kg / m3 | 1,173 |
| Smeltepunkt, ° C | -80,8 |
| Kogepunkt, ° C | -80,55 |
| Tredobbelt punkt, ° C | 335 |
| Selvantændelsestemperaturen, ° C | 335 |
| Selvantændelsestrykket, MPa | 0,14-0,16 |
| Kritisk temperatur *, ° C | Af 35.94 |
| Kritisk pres, MPa | 6,26 |
| Eksplosiv koncentration af blandingen af gas og luft, % efter volumen | 2.1 til 100 |
| Specifik forbrændingsvarme, MJ / kg | 56,9 |
| Flammetemperatur, ° C | 3150-3200 |
| Molar masse, g / mol | 26,038 |
* ved temperaturer over den kritiske temperatur gassen kan ikke kondenseres under noget tryk.
Kemiske egenskaber af acetylen:
Kemiske egenskaber ved acetylen svarer til egenskaberne hos andre repræsentanter for et antal alkyner. Så det er karakteriseret ved følgende kemiske reaktioner:
1. galogenirovannami acetylen:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibromethan);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabromethan).
Reaktionen forløber trinvis med dannelsen af derivater af alkaner.
Under denne reaktion, acetylen misfarvet brom vand.
2. hydrohalogenering acetylen:
CH≡CH + HBr → CH2 = CHBr (bromat).
3. hydrering af acetylen (reaktion Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldehyd ) (kat = HgSO4, Hg(NO3)2).
4. trimerisering af acetylen (reaktion Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (benzen) (kat = aktivt kul, til = 450-500 DET).
Reaktionen ved trimering af acetylen er et specielt tilfælde af reaktionen af polymerisering af acetylen opstår ved at passere acetylen over aktiveret trækul ved en temperatur på 450-500 DET.
5. dimerisering af acetylen:
CH≡CH + CH2CH → CH2 = CH-C2CH (opnået vinylacetylen) (kat = vandig opløsning af CuCl og NH 4 CL).
Reaktionen med dimerisering af acetylen er et specielt tilfælde af reaktionen af polymerisering af acetylen.
6. forbrændingen af acetylen:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Acetylen brænder med en hvid lys flamme.
7. oxidationen af acetylen.
Reaktionen og dens produkter bestemmes af det miljø, hvori den forekommer.
8. genvinding af acetylen:
CH≡CH + H2 → C2H4 (ethylen) (kat = Ni, Pd eller Pt, steget til);
CH≡CH + 2H2 → C2H6 (etan) (kat = Ni, Pd eller Pt, steget til).
Produktion af acetylen i industrien og laboratoriet. Kemisk reaktion - ligning acetylen:
Acetylen i laboratoriet er resultatet af følgende kemiske reaktioner:
1. virkningen af vand på calciumcarbid:
CaC2 + H2O → CA(Åh)2 + C2H2.
2. dehydrogenering af methan:
2CH4 → C2H2 + 3H2 (underlagt > 1500 OC).
3. dehydrogenering af ethylen:
CH2 = CH2 → CH2CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, til = 400-600 ° C).
Acetylen i branchen modtage på følgende måder og metoder:
4. hårdmetal metode:
Få først kalk fra calciumcarbonat.
CaCO3 → Høj + CO2. (til = 900-1200 oC).
Så tag et hårdmetal af calcium, smeltning calciumoxid og koks i en elektrisk ovn ved en temperatur på 2500-3000 ° C.
Høj + 3C → CaC2 + HVAD. (til = 2500-3000 DET).
Yderligere, calciumcarbid behandles med vand ved en kendt reaktion.
CaC2 + H2O → CA(Åh)2 + C2H2.
Resultatet er en acetylen med høj renhed er 99.9 %.
5. høj temperatur krakning af metan:
Højtemperatur krakning af methan udføres ifølge kendt reaktion degidrirovaniya af methan i en elektrisk lysbueovn ved en temperatur på 2000-3000 ° C og en spænding mellem elektroderne på 1000 V. output af acetylen er 50 %.
6. de forskellige former for pyrolyse af metan:
En type højtemperatur-krakning af metan er regenerativ pyrolyse (Wulff-proces), oxidativ pyrolyse (Sachs-proces eller BASF-proces), homogen pyrolyse, pyrolyse i mediet med lav temperatur plasma.
Dermed, under den regenerative pyrolyse brænd først metan og opvarm dysen af ovnen til 1350-1400 ° C. Derefter gennem en opvarmet dyse for at afskære metanstrømmen, derved dannelse af acetylen.
I løbet af oxidativ blanding blandes pyrolyse af ilt og brændes. Den resulterende varme tjener til at opvarme resten af metanen til 1600 ° C, hvilken digidrive i acetylen. Udbyttet af acetylen er 30-32 %.
Under den homogene pyrolyse af methan og ilt brændes der ind en ovn ved en temperatur på 2000 ° C. Derefter, forvarmet til 600 ° C, resten af metanen føres gennem ovnen, derved dannelse af acetylen.
Under pyrolyse i et miljø med lav temperatur plasma methan opvarmes med en stråle af ioniseret gas (argon eller hydrogen).
Anvendelse og anvendelse af acetylen:
- som råmateriale i den kemiske industri til produktion af eddikesyre, Ætanol, opløsningsmidler, plast, syntetisk gummi, aromatiske kulbrinter,
- til gassvejsning og skæring af metaller,
- til teknisk kulstof,
- som en kilde til meget lys, hvidt lys i det autonome lamper, hvor det opnås ved omsætning af calciumcarbid og vand.
Eksplosivitet af acetylen og sikkerhed ved håndtering:
Acetylen har eksplosive egenskaber.
Derfor, behandling med acetylen kræver nøje overholdelse af sikkerhedsregler.
Acetylen forbrænder og eksploderer selv i fravær af ilt og andre oxidationsmidler.
Blandinger af acetylen med luft er eksplosiv i en meget bred vifte af koncentrationer.
En stråle af acetylenfrigivet i det fri, kan antænde fra den mindste gnist, inklusive afladning af statisk elektricitet fra fingeren.
Vzryvaet acetylen afhænger af mange faktorer: tryk, temperatur, renhed af acetylen, indholdet af fugt, tilstedeværelsen af katalysatorer og andre stoffer og andre årsager.
Antændelsestemperaturen for acetylen ved normalt - atmosfærisk tryk i området 500-600 ° C. Når trykket falder markant, antændes temperaturen for acetylen. Dermed, ved et tryk på 2 kgf / cm2 (0.2 MPa, 1,935682 Hæveautomat.) antændelsestemperaturen for acetylen er lig med 630 ° C. Og ved et tryk på 22 kgf / cm2 (2.2 MPa, 21,292502 Hæveautomat.) antændelsestemperaturen for acetylen lig med 350 ° C.
Tilstedeværelsen af acetylen af partikler af forskellige stoffer øger overfladekontakten og reducerer dermed antændelsestemperaturen ved atmosfærisk tryk. For eksempel, aktivt kul sænker antændelsestemperaturen for acetylen til 400 ° C, hydratet af jernoxid (rust) - op til 280-300 ° C, jernspåner - op til 520 ° C, messing spåner op til 500-520 ° C, carbid af calcium, op til 500 ° C, aluminiumoxid - op til 490 ° C, kobberspåner - 460 ° C, jernoxidet - 280 ° C, kobberoxid op til 250 ° C.
Eksplosivitet af acetylen falder med fortynding af acetylen med andet gasser, for eksempel nitrogen, metan eller propan.
Under visse betingelser reagerer acetylen med kobber, sølv og kviksølv til dannelse af eksplosive forbindelser. Derfor, til fremstilling af acetylenudstyr (f.eks., ventiler, cylindre) Brug ikke legeringerindeholder mere end 70 % Med.
Opbevaring og transport af acetylen, ved hjælp af specielle stålcylindre hvid farve (med en rød indskrift “EN”) fyldt med en inaktiv porøs materiale (f.eks., trækul). Dermed acetylen opbevares og transporteres i disse poser i form af en opløsning af acetylen i acetone under tryk på 1.5-2.5 MPa.
Bemærk: © Foto //www.pexels.com, //Pixabay.com



