Acetylén, příprava, vlastnosti, chemické reakce

Acetylén, příprava, vlastnosti, a chemické reakce.
Acetylén, C2H2 - třída organické hmoty, alkyny, nenasycené uhlovodíky.
Acetylén, vzorec, plyn, Specifikace, charakteristiky
Fyzikální vlastnosti acetylenu
Výroba acetylenu v průmyslu a laboratořích
Chemická reakce - rovnice acetylen
Výbušnost acetylenu a bezpečnost při manipulaci
Acetylén, vzorec, plyn, funkce:
Acetylén (také - jene) - třída organické hmoty, alkyny, nenasycené uhlovodíkskládající se ze dvou atomů uhlíku a dvou atomů vodíku.
Chemická látka vzorec acetylenu je C2H2. Strukturní vzorec acetylenu, CH≡CH. Isomery ne.
Struktura molekuly acetylenu:
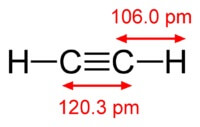
Acetylén má trojnou vazbu mezi atomy uhlíku.
Acetylén - bezbarvý plyn, bez chuti a vůně. nicméně, technický acetylen obsahuje nečistoty - fosfor vodík, sirovodík, atd., které jí dodávají štiplavý zápach.
Snadnější vzduch. Hustota ve srovnání s hustotou vzduchu z 0.9.
Velmi hořlavý plyn. Hořlavý a výbušný.
Acetylén je jednou z mála sloučenin, spalování a výbuch, který je možný v nepřítomnosti kyslíku nebo jiná oxidační činidla.
Směsi acetylenu s vzduch je výbušný ve velmi širokém rozmezí koncentrací. Při zředění acetylenu na jiné plyny se nebezpečí výbuchu snižuje, například dusík, metan nebo propan.
Acetylén vyžaduje velkou opatrnost při zacházení. Může explodovat šokem, při zahřátí na 500 ° C nebo při vyšší kompresi 0.2 MPa při pokojové teplotě. Proud acetylenu vypouštěný do venkovního prostředí vzduch, se může vznítit z nejmenší jiskry, včetně výboje statické elektřiny z prstu. Skladování acetylenu pomocí speciálních válcenaplněný porézním materiálem namočeným v acetonu. Acetylen se skladuje v roztoku s acetonem.
Mírně rozpustný v voda. Velmi dobře rozpustný v acetonu. Rozpustný v jiných organických látkách (benzín, benzen, atd.)
Acetylén má mírně toxický účinek.
Fyzikální vlastnosti acetylenu:
| Název parametru: | Hodnota: |
| Barva | bez barvy |
| Vůně | bez zápachu |
| Chuť | žádná chuť |
| Souhrnný stav (v 20 ° C a atmosférický tlak 1 BANKOMAT.) | plyn |
| Hustota (v 20 ° C a atmosférický tlak 1 BANKOMAT.) kg / m3 | 1,0896 |
| Hustota (v 0 ° C a atmosférický tlak 1 BANKOMAT.) kg / m3 | 1,173 |
| Bod tání, ° C | -80,8 |
| Bod varu, ° C | -80,55 |
| Trojitý bod, ° C | 335 |
| Teplota samovznícení, ° C | 335 |
| Tlak samovznícení, MPa | 0,14-0,16 |
| Kritická teplota *, ° C | Z 35.94 |
| Kritický tlak, MPa | 6,26 |
| Výbušná koncentrace směsi plynu se vzduchem, % podle objemu | 2.1 na 100 |
| Specifické spalné teplo, MJ / kg | 56,9 |
| Teplota plamene, ° C | 3150-3200 |
| Molární hmotnost, g / mol | 26,038 |
* při teplotách nad kritickou teplotou plyn nemohou kondenzovat za žádného tlaku.
Chemické vlastnosti acetylenu:
Chemické vlastnosti acetylenu jsou podobné vlastnostem jiných zástupců řady alkynů. Vyznačuje se tedy následujícími chemickými reakcemi:
1. galogenirovannami acetylen:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibromethan);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabromethan).
Reakce probíhá ve fázích s tvorbou derivátů alkanů.
Během této reakce, acetylen discolor brom voda.
2. hydrohalogenační acetylen:
CH≡CH + HBr → CH2 = CHBr (bromičnan).
3. hydratace acetylenu (reakce Michael G.. Kucherov, 1881):
CH≡CH + NaOH → Cu [CH2 = CH-OH] (enol) → CH3-CH = O (acetaldehyd ) (kat = HgSO4, Hg(NO3)2).
4. trimerace acetylenu (reakce Nikolaya Dmitrievicha zelinskogo, 1927):
3Н≡Н≡CH → C6H6 (benzen) (kat = aktivní uhlí, do = 450-500 THE).
Reakce trimerace acetylenu je zvláštním případem reakce polymerace acetylenu dochází průchodem acetylenu přes aktivovaný dřevěné uhlí při teplotě 450-500 THE.
5. dimerizace acetylenu:
CH≡CH + CH2CH → CH2 = CH-C = CH (získaný vinyl acetylen) (kat = vodný roztok CuCl a NH 4 CL).
Zvláštním případem reakce je dimerizace acetylenu polymerace acetylenu.
6. spalování acetylenu:
2SN≡CH + 5О2 → 4СО2 + 2О2О.
Acetylen hoří bílým jasným plamenem.
7. oxidace acetylenu.
Reakce a její produkty jsou určeny prostředím, ve kterém k ní dochází.
8. zpětné získání acetylenu:
CH≡CH + H2 → C2H4 (ethylen) (kat = Ni, Pd nebo Pt, zvýšil na);
CH≡CH + 2H2 → C2H6 (etan) (kat = Ni, Pd nebo Pt, zvýšil na).
Výroba acetylenu v průmyslu a laboratoři. Chemická reakce - rovnice acetylen:
Acetylén v laboratoři je výsledkem následujících chemických reakcí:
1. působení vody na karbid vápníku:
CaC2 + H2O → CA.(Ach)2 + C2H2.
2. dehydrogenace methanu:
2CH4 → C2H2 + 3H2 (podléhá > 1500 OC).
3. dehydrogenace ethylenu:
CH2 = CH2 → CH2CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, do = 400-600 ° C).
Acetylén v průmyslu přijímat následujícími způsoby a metodami:
4. karbidová metoda:
Nejprve si vezměte vápno z uhličitanu vápenatého.
CaCO3 → vysoký + CO2. (do = 900-1200 oC).
Pak získejte karbid vápníku, fixační oxid vápenatý a koks v elektrické peci při teplotě 2500-3000 ° C.
Vysoký + 3C → CaC2 + CO. (do = 2500-3000 THE).
Dále, je zpracován karbid vápníku s vodou při známé reakci.
CaC2 + H2O → CA.(Ach)2 + C2H2.
Výsledkem je vysoce čistý acetylen 99.9 %.
5. vysokoteplotní krakování metanu:
Vysokoteplotní krakování metanu se provádí podle známé reakce degidrirovaniya metanu v elektrické obloukové peci při teplotě 2000-3000 ° C a napětí mezi elektrodami o 1000 PROTI. výstup acetylenu je 50 %.
6. různé způsoby pyrolýzy methanu:
Typem vysokoteplotního krakování metanu je regenerativní pyrolýza (Wulffův proces), oxidativní pyrolýza (Sachs-proces nebo BASF proces), homogenní pyrolýza, pyrolýza v médiu o nízké teplotě plazma.
Tím pádem, během regenerativní pyrolýzy nejprve spalte metan a zahřejte trysku pece na 1350-1400 ° C. Poté pomocí vyhřívané trysky odříznout tok metanu, čímž se vytvoří acetylen.
V průběhu oxidační pyrolýzy je methan smíchán s kyslíkem a spálen. Výsledné teplo slouží k ohřevu zbytku metanu na 1600 ° C, které digidrive v acetylenu. Výtěžek acetylenu je 30-32 %.
Během homogenní pyrolýzy metanu a kyslíku se spaluje pec při teplotě 2000 ° C. Pak, předehřátý na 600 ° C, zbytek methanu prochází pecí, čímž se vytvoří acetylen.
Během pyrolýzy v prostředí s nízkou teplotou plazma metan je zahříván paprskem ionizovaného plynu (argon nebo vodík).
Aplikace a použití acetylenu:
- jako surovina v chemickém průmyslu pro výrobu kyseliny octové, ethylalkohol, rozpouštědla, plasty, syntetický gumy, aromatické uhlovodíky,
- pro plynové svařování a řezání kovů,
- pro technické uhlík,
- jako zdroj velmi jasný, bílé světlo v autonomní oblasti lampy, kde se získává reakcí karbidu vápníku a vody.
Výbušnost acetylenu a bezpečnost při manipulaci:
Acetylén má výbušné vlastnosti.
Proto, ošetření acetylenem vyžaduje přísné dodržování bezpečnostních pravidel.
Acetylén hoří a exploduje i při absenci kyslíku a jiných oxidačních činidel.
Směsi acetylenu se vzduchem jsou výbušný ve velmi širokém rozmezí koncentrací.
Proud acetylenuvypuštěn pod širým nebem, se může vznítit z nejmenší jiskry, včetně výboje statické elektřiny z prstu.
Vzryvaet acetylen záleží na mnoha faktorech: tlak, teplota, čistota acetylenu, obsah vlhkosti, přítomnost katalyzátorů a jiných látek a další důvody.
Teplota vznícení acetylenu při normálním - atmosférickém tlaku v rozsahu 500-600 ° C. Když tlak výrazně sníží zápalnou teplotu acetylenu. Tím pádem, pod tlakem 2 kgf / cm2 (0.2 MPa, 1,935682 BANKOMAT.) teplota vznícení acetylenu se rovná 630 ° C. A pod tlakem 22 kgf / cm2 (2.2 MPa, 21,292502 BANKOMAT.) teplota vznícení acetylenu rovna 350 ° C.
Přítomnost acetylenu v částicích různých látek zvyšuje povrchový kontakt a tím snižuje teplotu vznícení při atmosférickém tlaku. Například, aktivní uhlí snižuje teplotu vznícení acetylenu na 400 ° C, hydrát oxidu železa (rez) - až do 280-300 ° C, železné hobliny - až 520 ° C, mosazné hobliny až 500-520 ° C, karbid vápníku, až do 500 ° C, oxid hlinitý - až 490 ° C, měděné hobliny - 460 ° C, oxid železitý - 280 ° C, oxid mědi až 250 ° C.
Výbušnost acetylenu klesá s ředěním acetylenu jinými plyny, například dusík, metan nebo propan.
Za určitých podmínek reaguje acetylen měď, stříbrný a rtuť za vzniku výbušných sloučenin. Proto, při výrobě acetylenového zařízení (např., ventily, válce) nepoužívat slitinyobsahující více než 70 % S.
Skladování a přeprava acetylenu, pomocí speciálních ocelových válců bílé barvy (s červeným nápisem “A”) naplněné inertním porézním materiálem materiál (např., dřevěné uhlí). Tím pádem acetylen je skladován a přepravován v těchto vakech ve formě roztoku acetylenu v acetonu pod tlakem 1.5-2.5 MPa.
Poznámka: © Foto //www.pexels.com, //Dreamstime.com



