Asetyleeni, valmistautuminen, ominaisuudet, kemialliset reaktiot

Asetyleeni, valmistautuminen, ominaisuudet, ja kemialliset reaktiot.
Asetyleeni, C2H2 - orgaanisten aineiden luokka, alkyynejä, tyydyttymättömät hiilivedyt.
Asetyleeni, kaava, kaasu, tekniset tiedot, ominaisuudet
Asetyleenin fysikaaliset ominaisuudet
Asetyleenin kemialliset ominaisuudet
Asetyleenin tuotanto teollisuudessa ja laboratorioissa
Kemiallinen reaktio - yhtälö asetyleeni
Asetyleenin räjähtävyys ja käsittelyn turvallisuus
Asetyleeni, kaava, kaasu, ominaisuudet:
Asetyleeni (myös - jene) - orgaanisten aineiden luokka, alkyynejä, tyydyttymätön hiilivetyjoka koostuu kahdesta hiiliatomista ja kahdesta vetyatomista.
Kemikaali asetyleenin kaava on C2H2. Asetyleenin rakennekaava, CH≡CH. Isomeerit eivät ole.
Asetyleenimolekyylin rakenne:
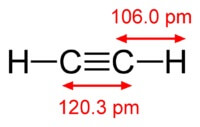
Asetyleeni on kolmoissidos atomien välillä hiiltä.
Asetyleeni - väritön kaasu, ilman makua ja hajua. kuitenkin, tekninen asetyleeni sisältää epäpuhtauksia - fosforia vety, rikkivety, jne., jotka antavat sille pistävän tuoksun.
Helpompaa ilmaa. Tiheys verrattuna tiheyteen ilman / 0.9.
Erittäin helposti syttyvä kaasu. Syttyvä ja räjähtävä.
Asetyleeni on harvojen yhdisteiden joukossa, palaminen ja räjähdys, joka on mahdollista ilman poissaoloa happea tai muita hapettavia aineita.
Asetyleenin seokset ilmaa on räjähtävä hyvin laajalla pitoisuusalueella. Räjähdysvaarat vähenevät laimennettaessa asetyleeniä muita kaasuja, esimerkiksi typpeä, metaani tai propaani.
Asetyleeni vaatii suurta huolellisuutta käsittelyssä. Voi räjähtää sokista, kun lämmitetään 500 ° C tai kun se on pakattu yli 0.2 MPa huoneenlämmössä. Asetyleenivirta vapautuu ulkona ilmaa, voi syttyä pienimmästä kipinästä, staattinen sähkö purkautuu sormesta. Asetyleenin varastointi erityisillä sylinterittäytetty huokoisella materiaalilla, joka on kastettu asetonilla. Ne asetyleeniä varastoidaan liuoksessa asetonin kanssa.
Hieman liukenee vettä. Hyvin liukoinen asetoniin. Liukenee muihin orgaanisiin aineisiin (bensiini, bentseeni, jne.)
Asetyleeni on lievä myrkyllinen vaikutus.
Asetyleenin fysikaaliset ominaisuudet:
| Parametrin nimi: | Arvo: |
| Väri | ilman väriä |
| Haju | hajuton |
| Maku | Ei makua |
| Kokonaistila (klo 20 ° C ja ilmanpaine 1 Pankkiautomaatti.) | kaasu |
| Tiheys (klo 20 ° C ja ilmanpaine 1 Pankkiautomaatti.) kg / m3 | 1,0896 |
| Tiheys (klo 0 ° C ja ilmanpaine 1 Pankkiautomaatti.) kg / m3 | 1,173 |
| Sulamispiste, ° C | -80,8 |
| Kiehumispiste, ° C | -80,55 |
| Kolmoispiste, ° C | 335 |
| Itsesyttymislämpötila, ° C | 335 |
| Itsesyttymispaine, MPa | 0,14-0,16 |
| Kriittinen lämpötila *, ° C | Of 35.94 |
| Kriittinen paine, MPa | 6,26 |
| Räjähtävä pitoisuus kaasuseoksessa ilman kanssa, % tilavuuden mukaan | 2.1 että 100 |
| Erityinen palamislämpö, MJ / kg | 56,9 |
| Liekin lämpötila, ° C | 3150-3200 |
| Moolimassa, g / mol | 26,038 |
* kriittisen lämpötilan yläpuolella kaasu ei voi tiivistyä missään paineessa.
Asetyleenin kemialliset ominaisuudet:
Asetyleenin kemialliset ominaisuudet ovat samanlaisia kuin useiden alkyynien muiden edustajien ominaisuudet. Joten sille on ominaista seuraavat kemialliset reaktiot:
1. galogenirovannami-asetyleeni:
CH≡CH + Br2 → CHBr = CHBr (1,2-dibrometaani);
CHBr = CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-tetrabromietaani).
Reaktio etenee vaiheittain muodostamalla johdannaisia alkaanien.
Tämän reaktion aikana, asetyleenivärin bromi vettä.
2. hydrohalogenointiasetyleeni:
CH≡CH + HBr → CH2 = CHBr (bromaatti).
3. asetyleenin nesteytys (reaktio Michael G. Kucherov, 1881):
CH≡CH + H2O → [CH2 = CH-OH] (enol) → CH3-CH = O (asetaldehydi ) (kat = HgSO4, Hg(NO3)2).
4. asetyleenin trimerointi (reaktio Nikolaya Dmitrievicha zelinskogo, 1927):
3СН≡CH → C6H6 (bentseeni) (kat = aktiivihiili, = = 450-500 THE).
Asetyleenin trimeroinnin reaktio on reaktion erityistapaus asetyleenin polymerointi tapahtuu siirtämällä asetyleeni aktivoidun yli puuhiili lämpötilassa 450-500 THE.
5. asetyleenin dimerointi:
CH≡CH + CH≡CH → CH2 = CH-C2CH (saatu vinyyliasetyleeni) (kat = CuCl: n ja NH: n vesiliuos 4 CL).
Asetyleenin dimerointireaktio on reaktion erityistapaus asetyleenin polymerointi.
6. asetyleenin palaminen:
2SN≡CH + 5О2 → 4СО2 + 2Н2О.
Asetyleeni palaa valkoisella kirkkaalla liekillä.
7. asetyleenin hapettuminen.
Reaktio ja sen tuotteet määräytyvät sen ympäristössä, jossa se tapahtuu.
8. asetyleenin talteenotto:
CH≡CH + H2 → C2H4 (eteeni) (kat = Ni, Pd tai Pt, kasvoi);
CH≡CH + 2H2 → C2H6 (etaani) (kat = Ni, Pd tai Pt, kasvoi).
Asetyleenin tuotanto teollisuudessa ja laboratoriossa. Kemiallinen reaktio - yhtälö asetyleeni:
Asetyleeni laboratoriossa on seurausta seuraavista kemiallisista reaktioista:
1. veden vaikutus kalsiumkarbidiin:
CaC2 + H2O → CA(vai niin)2 + C2H2.
2. metaanin dehydraus:
2CH4 → C2H2 + 3H2 (jollei > 1500 OC).
3. eteenin dehydraus:
CH2 = CH2 → CH2CH + H2 (kat = Pt, Ni, Al2O3, Cr2O3, = = 400-600 ° C).
Asetyleeni teollisuudessa vastaanottaa seuraavilla tavoilla ja menetelmillä:
4. kovametallimenetelmä:
Hanki ensin kalkkia kalsiumkarbonaatista.
CaCO3 → korkea + CO2. (= = 900-1200 oC).
Hanki sitten kovametalli kalsiumia, fuusiointi kalsiumoksidi ja koksi sähköuunissa lämpötilassa 2500-3000 ° C.
Korkea + 3C → CaC2 + MITÄ. (= = 2500-3000 THE).
Edelleen, kalsiumkarbidia käsitellään vedellä tunnetulla reaktiolla.
CaC2 + H2O → CA(vai niin)2 + C2H2.
Tuloksena on erittäin puhdasta asetyleeniä 99.9 %.
5. metaanin krakkaaminen korkeassa lämpötilassa:
Metaanin korkeassa lämpötilassa krakkaus suoritetaan metaanin tunnetun reaktion degidrirovaniyan mukaisesti valokaariuunissa lämpötilassa 2000-3000 ° C ja elektrodien välinen jännite 1000 V. asetyleenin tuotos on 50 %.
6. metaanin pyrolyysin eri muodot:
Eräs korkean lämpötilan metaanin krakkaus on regeneratiivinen pyrolyysi (Wulff-prosessi), hapettava pyrolyysi (Sachs-prosessi tai BASF-prosessi), homogeeninen pyrolyysi, pyrolyysi matalan lämpötilan väliaineessa plasma.
Täten, regeneratiivisen pyrolyysin aikana poltetaan ensin metaani ja lämmitetään suutin uunista että 1350-1400 ° C. Sitten lämmitetyn suuttimen läpi metaanivirtauksen katkaisemiseksi, muodostaen siten asetyleeniä.
Metaanin oksidatiivisen pyrolyysin aikana sekoitetaan happeen ja poltetaan. Tuloksena oleva lämpö lämmittää loput metaanista 1600 ° C, jotka johtavat asetyleenissä. Asetyleenin saanto on 30-32 %.
Metaanin ja hapen homogeenisen pyrolyysin aikana palaa uuni lämpötilassa 2000 ° C. Sitten, esilämmitetty 600 ° C, loput metaanista johdetaan uunin läpi, muodostaen siten asetyleeniä.
Pyrolyysin aikana matalan lämpötilan ympäristössä plasma metaania kuumennetaan ionisoidulla kaasusuihkulla (argon tai vety).
Asetyleenin käyttö ja käyttö:
- kemianteollisuuden raaka-aineena etikkahapon tuotannossa, etyylialkoholi, liuottimet, muovit, synteettinen kumit, aromaattiset hiilivedyt,
- kaasuhitsaukseen ja metallien leikkaamiseen,
- tekniseen käyttöön hiili,
- erittäin kirkkaan lähteenä, valkoinen valo autonomisessa tilassa lamput, missä se saadaan kalsiumkarbidin ja veden reaktiolla.
Asetyleenin räjähtävyys ja käsittelyn turvallisuus:
Asetyleeni on räjähtäviä ominaisuuksia.
Siksi, käsittely asetyleenillä vaatii turvallisuussääntöjen tarkkaa noudattamista.
Asetyleeni palaa ja räjähtää jopa ilman happea ja muita hapettavia aineita.
Asetyleenin ja ilman seokset ovat räjähtävä hyvin laajalla pitoisuusalueella.
Asetyleenisuihkupäästetään ulkoilmaan, voi syttyä pienimmästä kipinästä, staattinen sähkö purkautuu sormesta.
Vzryvaet-asetyleeni riippuu monista tekijöistä: paine, lämpötila, asetyleenin puhtaus, kosteuden pitoisuus, katalyyttien ja muiden aineiden läsnäolo ja muut syyt.
Asetyleenin syttymislämpötila normaalissa - ilmanpaine alueella 500-600 ° C. Kun paine laskee merkittävästi asetyleenin syttymislämpötilaa. Täten, paineessa 2 kgf / cm2 (0.2 MPa, 1,935682 Pankkiautomaatti.) asetyleenin syttymislämpötila on yhtä suuri kuin 630 ° C. Ja paineella 22 kgf / cm2 (2.2 MPa, 21,292502 Pankkiautomaatti.) - asetyleenin syttymislämpötila on 350 ° C.
Eri aineiden hiukkasten asetyleenin läsnäolo lisää pintakosketusta ja vähentää siten syttymislämpötilaa ilmakehän paineessa. Esimerkiksi, aktiivihiili alentaa asetyleenin syttymislämpötilan 400 ° C, rautaoksidin hydraatti (ruoste) - aikeissa 280-300 ° C, rautalastut - jopa 520 ° C, messinki lastut jopa 500-520 ° C, karbidi kalsiumia, aikeissa 500 ° C, alumiinioksidi - enintään 490 ° C, kuparilastut - 460 ° C, rautaoksidi - 280 ° C, kuparioksidi enintään 250 ° C.
Asetyleenin räjähtävyys pienenee asetyleeniä laimennettaessa muilla kaasut, esimerkiksi typpeä, metaani tai propaani.
Tietyissä olosuhteissa asetyleeni reagoi kupari-, hopea ja elohopea muodostaa räjähtäviä yhdisteitä. Siksi, asetyleenilaitteiden valmistuksessa (esimerkiksi., venttiilit, sylinterit) Älä käytä seoksetsisältää enemmän kuin 70 % Kanssa.
Asetyleenin varastointi ja kuljetus, käyttämällä erikoisvalmisteisia terässylintereitä (punaisella merkinnällä “A”) täytetty inertillä huokoisella aineella materiaalia (esimerkiksi., puuhiili). Täten asetyleeni varastoidaan ja kuljetetaan näissä pusseissa asetyleeniliuoksen muodossa asetonissa paineen alaisena 1.5-2.5 MPa.
Huomautus: © Kuva //www.pexels.com, //pixabay.com



